题目内容
7.下列说法正确的是( )| A. | 分子晶体的熔点比金属晶体的低 | |
| B. | 在晶体中只要有阳离子,一定有阴离子 | |
| C. | 在SiO2晶体中,Si原子与Si-O键数目比为1:2 | |
| D. | 离子化合物中可能含有非极性共价键 |
分析 A.分子晶体的熔点不一定比金属晶体的低,可能比金属晶体高;
B.金属晶体是由金属阳离子和自由电子构成的;
C.二氧化硅晶体中每个Si原子含有4个Si-O键;
D.离子晶体中一定含有离子键,可能含有非极性键共价键.
解答 解:A.分子晶体的熔点不一定比金属晶体的低,可能比金属晶体高,如Hg常温下是液态,S的熔点高于Hg,故A错误;
B.金属晶体是由金属阳离子和自由电子构成的,含有金属阳离子的晶体可能是金属晶体,所以含有金属阳离子的晶体不一定含有阴离子,但含有阴离子的晶体一定含有阳离子,故B错误;
C.二氧化硅晶体中每个Si原子含有4个Si-O键,每个O原子形成两个Si-O键,故C错误;
D.离子晶体中一定含有离子键,可能含有非极性键共价键,如Na2O2,故D正确;
故选D.
点评 本题考查物质结构、晶体构成微粒、化学键、晶体熔沸点等知识点,明确物质构成特点及构成微粒是解本题关键,采用举例法分析解答,易错选项是B,注意:含有金属阳离子的晶体不一定含有阴离子,但含有阴离子的晶体一定含有阳离子.

练习册系列答案
相关题目
17.下列有关表示方法中,正确的是( )
| A. | 次氯酸的电子式为: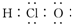 | |
| B. | 氮原子轨道表示式为: | |
| C. | 硫原子的最外层电子排布式为:3s23p4 | |
| D. | N2的结构式为::N≡N: |
18.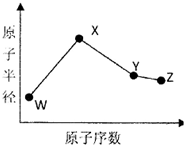 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目:W与Y的氧化物均能导致酸雨的形成;Z的非会属性在同周期主族元素中最强.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目:W与Y的氧化物均能导致酸雨的形成;Z的非会属性在同周期主族元素中最强.
(1)Y在周期表中的位置是第三周期第ⅥA族.
(2)用电子式表示化合物X3W的结构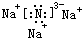 .
.
(3)X3W遇水可释放出使酚酞溶液变红的气体A,该反应的化学方程式是Na3N+3H2O=NH3↑+3NaOH.
(4)同温同压下,将a L W的简单氢化物和b LZ的氢化物通入水中,若所得溶液的pH=7则a>b(填“>”或“<”或“=”).
(5)用惰性电极电解化合物XZ溶液从阴极释放出气休B,该反应的离子方程式是2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
(6)已知W的单质与气体B在一定条件下可形成气体A,即:W2(g)+3B(g)?2A(g)△H=-92.4kJ•mo1-1
在某温度时,一个容积固定的密闭容器中,发生上述反应.在不同时间测定的容器内各物质的浓度如下表:
①0min~10min,W2的平均反应速率0.02mol/(L•min).
②反应在第l0min改变了反应条件,改变的条件可能是ab.
a.更新了催化剂b.升高温度c.增大压强d.增加B的浓度
③若反应从第30min末又发生了一次条件改变,改变的反应条件可能是b.
a.更新了催化剂b.升高温度c.增大压强d.减小A的浓度.
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目:W与Y的氧化物均能导致酸雨的形成;Z的非会属性在同周期主族元素中最强.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目:W与Y的氧化物均能导致酸雨的形成;Z的非会属性在同周期主族元素中最强.(1)Y在周期表中的位置是第三周期第ⅥA族.
(2)用电子式表示化合物X3W的结构
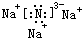 .
.(3)X3W遇水可释放出使酚酞溶液变红的气体A,该反应的化学方程式是Na3N+3H2O=NH3↑+3NaOH.
(4)同温同压下,将a L W的简单氢化物和b LZ的氢化物通入水中,若所得溶液的pH=7则a>b(填“>”或“<”或“=”).
(5)用惰性电极电解化合物XZ溶液从阴极释放出气休B,该反应的离子方程式是2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
(6)已知W的单质与气体B在一定条件下可形成气体A,即:W2(g)+3B(g)?2A(g)△H=-92.4kJ•mo1-1
在某温度时,一个容积固定的密闭容器中,发生上述反应.在不同时间测定的容器内各物质的浓度如下表:
| 时间 | 浓度(mo1/L) | ||
| c(W2) | c(B) | c(A) | |
| 第0min | 4.0 | 9.0 | 0 |
| 第10min | 3.8 | 8.4 | 0.4 |
| 第20min | 3.4 | 7.2 | 1.2 |
| 第30min | 3.4 | 7.2 | 1.2 |
| 第40min | 3.6 | 7.8 | 0.8 |
②反应在第l0min改变了反应条件,改变的条件可能是ab.
a.更新了催化剂b.升高温度c.增大压强d.增加B的浓度
③若反应从第30min末又发生了一次条件改变,改变的反应条件可能是b.
a.更新了催化剂b.升高温度c.增大压强d.减小A的浓度.
2.下列有关离子浓度的比较正确的是的( )
| A. | 0.1mol•L-1氨水中,c(OH-)<c(NH4+) | |
| B. | 10mL 0.02mol•L-1HCl溶液与10mL 0.02mol•L-1Ba(OH)2溶液充分混合,c(Cl-)>c(Ba2+)>c(OH-)=c(H+) | |
| C. | 将0.1mol•L-1CH3COONa和0.1mol•L-1NH4Cl等体积混合后的溶液中,c(H+)+c(CH3COOH)>c(NH3•H2O)+c(OH-) | |
| D. | 0.1mol•L-1某二元弱酸碱性NaHA溶液中,c(H+)+c(H2A)═c(A2-)+c(OH-) |
12.下列物质是共价化合物的是( )
| A. | KOH | B. | NaCl | C. | H2 | D. | CH4 |
19.下列物质:①丙氨酸 ②纤维素 ③蛋白质 ④小苏打 ⑤Al(OH)3 ⑥苯酚钠 ⑦CH3COONH4.其中既能与盐酸反应又能与NaOH反应的是( )
| A. | ①③④⑤⑦ | B. | 全部 | C. | ①③④⑤⑥ | D. | ①④⑤⑥ |
16.下列说法正确的是( )
| A. | CH4能使酸性KMnO4溶液褪色 | |
| B. | 金属Na能与C2H5OH中的甲基反应生成H2 | |
| C. | 乙酸有强烈的刺激性气味,其水溶液称为冰醋酸 | |
| D. | CH3CH2CH2CH3与CH3CH(CH3)2互为同分异构体 |
17.将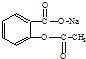 转变为
转变为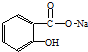 的方法正确的是( )
的方法正确的是( )
 转变为
转变为 的方法正确的是( )
的方法正确的是( )| A. | 与足量的NaOH溶液共热后,再通入足量的CO2 | |
| B. | 与稀H2SO4共热后,加入足量的Na2CO3 | |
| C. | 与足量的NaOH溶液共热后,加入足量的稀H2SO4 | |
| D. | 与稀H2SO4共热后,加入足量的NaOH |