题目内容
【题目】为研究哈伯法合成氨反应,T℃时,在容积为2 L恒容容器中通入4 mol N2和12mol H2,反应如下: N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.0kJmol-1,相关键能数据如下:
2NH3(g) △H=-92.0kJmol-1,相关键能数据如下:
N≡N | H-H | N-H | |
键能数据( kJ/mol) | 946 | 436 | X |
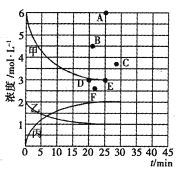
若25min时反应达到平衡,各物质浓度随时间变化曲线如下图中甲、乙、丙。回答下列问题:
(1)0-25min内,反应的平均速率v(H2)为_________;表中X=_________________。
(2)T℃时,该反应的平衡常数K=_____________ (用最简分数表达)。
(3)T℃时,若起始充入8mol N2和24 mol H2,则反应刚达到平衡时,表示c( H2)在右图中相应的点为_____(填字母)。
(4)以煤为主要原料的合成氨工业中,原料气氢气常用下述方法获得:
①C(s) +H2O(g)![]() CO(g) +H2(g) △H1
CO(g) +H2(g) △H1
②CO(g) +H2O(g)![]() CO2(g) +H2(g) △H2
CO2(g) +H2(g) △H2
若已知CO和H2的燃烧热分别为283 kJ·mol-l和285.8kJ·mol-l;H2O( g) =H2O(1) △H =-44kJ·mol-l 则△H2=_______________。
(5)氨气是生产硝酸的重要原料,其过程如下:
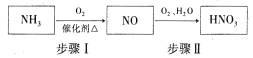
写出步骤I的化学方程式:_________________。
(6)下图是科学家提出的利用电解法常温常压下由氮气、氢气合成氨的示意图:
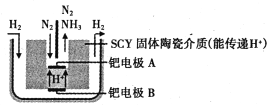
由图可知,钯电极B是电解池的________(填“阴极”或“阳极”);钯电极A上的电极反应式为________。
【答案】 0.12 moI/(L·min) 391 ![]() B -41.2 kJ·mol-1 4NH3 +5O2
B -41.2 kJ·mol-1 4NH3 +5O2![]() 4NO +6H2O 阳极 N2+6e-+6H+=2NH3
4NO +6H2O 阳极 N2+6e-+6H+=2NH3
【解析】(1) 在容积为2 L恒容容器中通入4 mol N2和12mol H2,根据图像,0-25min内,氢气的浓度变成3mol/L,反应的平均速率v(H2)= ![]() =
=![]() = 0.12 moI/(L·min); △H=-92.0KJmol-1=946+436×2-6X,解得X=391 KJmol-1,故答案为:0.12 moI/(L·min);391;
= 0.12 moI/(L·min); △H=-92.0KJmol-1=946+436×2-6X,解得X=391 KJmol-1,故答案为:0.12 moI/(L·min);391;
(2)T℃时,平衡时c(N2)=1mol/L,c(H2)=3mol/L,c(NH3)=2mol/L,该反应的平衡常数K= =
=![]() =
=![]() ,故答案为:
,故答案为: ![]() ;
;
(3)T℃时,若起始充入8mol N2和24 mol H2,相当于增大压强,若平衡不移动,氢气的浓度为原来的2倍为6mol.L,而增大压强,平衡正向移动,c( H2)减小,反应速率加快,建立平衡需要的时间缩短,故选B;
(4)已知:①CO(g)+![]() O2(g)═CO2(g)△H=-283.0kJ/mol;②H2(g)+
O2(g)═CO2(g)△H=-283.0kJ/mol;②H2(g)+![]() O2(g)═H2O(l)△H=-285.8kJ/mol;③H2O( g) =H2O(1) △H =kJ·mol-l,由盖斯定律可知,①-②+③可得CO(g)+H2O(g)=CO2(g)+H2(g)△H=-283.0kJ/mol-(-285.8)+(-44 kJ/mol)=-41.2kJ/mol,故答案为: -41.2kJ/mol;
O2(g)═H2O(l)△H=-285.8kJ/mol;③H2O( g) =H2O(1) △H =kJ·mol-l,由盖斯定律可知,①-②+③可得CO(g)+H2O(g)=CO2(g)+H2(g)△H=-283.0kJ/mol-(-285.8)+(-44 kJ/mol)=-41.2kJ/mol,故答案为: -41.2kJ/mol;
(5)步骤I中氨气被氧化为NO ,反应的化学方程式为4NH3 +5O2![]() 4NO +6H2O,故答案为:4NH3 +5O2
4NO +6H2O,故答案为:4NH3 +5O2![]() 4NO +6H2O;
4NO +6H2O;
(6)由图可知,钯电极A上氮气反应生成了氨气,发生了还原反应,是阴极,则是钯电极B是电解池的阳极;钯电极A上的电极反应式为N2+6e-+6H+=2NH3,故答案为:阳极;N2+6e-+6H+=2NH3。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案