题目内容
【题目】NH3与Cl2反应的产物不可能是( )
A.N2、HCl
B.NH4Cl、H2
C.N2、NH4Cl
D.N2、HCl、NH4Cl
【答案】B
【解析】解:氯气与氨气具有强的氧化性,能够发生反应生成氮气和氯化氢,氨气能够与氯化氢反应生成氯化铵,所以当氨气少量,反应生成氮气和氯化氢,氨气过量氨气与氯化氢反应生成氯化铵固体,不可能生成氢气,故选:B.
氯气与氨气具有强的氧化性,能够发生反应生成氮气和氯化氢,氨气能够与氯化氢反应生成氯化铵,据此解答.

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案【题目】为研究哈伯法合成氨反应,T℃时,在容积为2 L恒容容器中通入4 mol N2和12mol H2,反应如下: N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.0kJmol-1,相关键能数据如下:
2NH3(g) △H=-92.0kJmol-1,相关键能数据如下:
N≡N | H-H | N-H | |
键能数据( kJ/mol) | 946 | 436 | X |
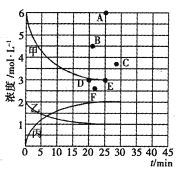
若25min时反应达到平衡,各物质浓度随时间变化曲线如下图中甲、乙、丙。回答下列问题:
(1)0-25min内,反应的平均速率v(H2)为_________;表中X=_________________。
(2)T℃时,该反应的平衡常数K=_____________ (用最简分数表达)。
(3)T℃时,若起始充入8mol N2和24 mol H2,则反应刚达到平衡时,表示c( H2)在右图中相应的点为_____(填字母)。
(4)以煤为主要原料的合成氨工业中,原料气氢气常用下述方法获得:
①C(s) +H2O(g)![]() CO(g) +H2(g) △H1
CO(g) +H2(g) △H1
②CO(g) +H2O(g)![]() CO2(g) +H2(g) △H2
CO2(g) +H2(g) △H2
若已知CO和H2的燃烧热分别为283 kJ·mol-l和285.8kJ·mol-l;H2O( g) =H2O(1) △H =-44kJ·mol-l 则△H2=_______________。
(5)氨气是生产硝酸的重要原料,其过程如下:
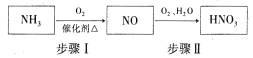
写出步骤I的化学方程式:_________________。
(6)下图是科学家提出的利用电解法常温常压下由氮气、氢气合成氨的示意图:
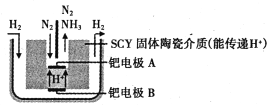
由图可知,钯电极B是电解池的________(填“阴极”或“阳极”);钯电极A上的电极反应式为________。
