��Ŀ����
����Ŀ����ѧ������ָ��ʹ���������������������ԭ�����������Ƽ��ı���������һ�����ķ�������������(NaH2PO2)����ѧ��������Ҫԭ������ҵ���Ʊ�NaH2PO2��H2O������������

�ش���������:
����������(NaH2PO2)�Ǵ�����(H3PO2)������NaOH��Һ��Ӧ�IJ�����NaH2PO2����_______(��������������ʽ��������ʽ�������� NaH2PO2����Ԫ���Ļ��ϼ�Ϊ___________��
(2)����Ӧ���м����黯��������������Ŀ����________________
(3)�ڷ�Ӧ���з��������Ӧ�����а���(P4)��Ca(OH)2��Ӧ���ɴ������Ƽ�������Ļ�ѧ����ʽΪ_________________________
(4)������ͨ��CO2��Ŀ����______________������X�Ļ�ѧʽΪ_____________
(5)������ĸҺ�е����ʳ�NaH2PO2�⣬���е�һ����Ҫ�ɷ�Ϊ_____________
(6)��PH3�ķ�������NaClO��NaOH�������Һ��������ת��Ϊ���������÷�Ӧ�����ӷ���ʽΪ____________
(7)ij������Ͷ���ԭ�ϰ���Ϊ1240 kg���������黯��Ӧ������80%�İ���ת��Ϊ�������Ƽ������������������������ʧ�����������յõ���ƷNaH2PO2��H2O������ӦΪ__________kg(NaH2PO2��H2O����Է�������Ϊ106)
���𰸡� ���� +1 �ӿ췴Ӧ���� 2P4+3Ca(OH)2+6H2O=3Ca(H2PO2)2+2PH3�� ��Ca(H2PO2)2 ת��ΪNaH2PO2 CaCO3 Na2HPO3 PH3+4ClO-+3OH-=PO43-+4Cl-+3H2O 2544
�����������⿼�黯ѧ�������̣��漰����ѧ��Ӧԭ����֪ʶ�����ã���1�����������Ǵ��������������������Ʒ�Ӧ�IJ����˴������������Σ�����Na�ԣ�1�ۣ����ԣ�1�ۣ����ԣ�2�ۣ��������ϼ۵Ĵ�����Ϊ0��P�Ļ��ϼ��ǣ�1�ۣ���2�������Ŀ�������ӽӴ���������ٷ�Ӧ���ʣ���3������P4��Ca(OH)2��Ca(H2PO2)2��PH3��P4��Ca(H2PO2)2��P�Ļ��ϼ���0����1�ۣ�����1�ۣ�������2�ۣ�P4��PH3��P�Ļ��ϼ���0����3�ۣ�����3�ۣ���С������Ϊ6����Ca(H2PO2)2ϵ��Ϊ3��PH3��ϵ��Ϊ2������ԭ���غ㣬��Ӧ����ʽΪ2P4��3Ca(OH)2=3Ca(H2PO2)2��2PH3����4��CO2��NaOH��Ӧ����Na2CO3��̼���������ˮ��ͨ��CO2��Ŀ���dz�ȥCa2��������Ca(H2PO2)2 ת��ΪNaH2PO2 ��������XΪCaCO3����5����������ͼ��ĸҺ�л�����NH2HPO3����6������ClO��������������PH3������PO43����PH3��ClO����PO43����Cl����P�Ļ��ϼ��ɣ�3�ۡ���5�ۣ����ϼ�����8�ۣ�Cl�ɣ�1�ۡ���1�ۣ�����2�ۣ���С������Ϊ8��PH3��4ClO����PO43����4Cl���������Ǽ��ԣ�����ѭ��Ӧǰ�����������������ȣ���PH3��4ClO����3OH��=PO43����4Cl��+3H2O����7������������Ӧ��������ϵʽ��2P4��3Ca(H2PO2)2��6NaH2PO2��H2O��m(NaH2PO2��H2O)=1240��80%��6��106/(31��4��2)kg=2544kg��

 53���ò�ϵ�д�
53���ò�ϵ�д�����Ŀ��Ϊ�о��������ϳɰ���Ӧ��T��ʱ�����ݻ�Ϊ2 L����������ͨ��4 mol N2��12mol H2����Ӧ���£� N2(g)+3H2(g) ![]() 2NH3(g) ��H=-92.0kJmol-1����ؼ����������£�
2NH3(g) ��H=-92.0kJmol-1����ؼ����������£�
N��N | H-H | N-H | |
��������( kJ/mol) | 946 | 436 | X |
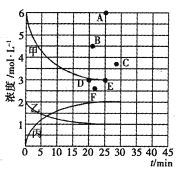
��25minʱ��Ӧ�ﵽƽ�⣬������Ũ����ʱ��仯��������ͼ�мס��ҡ������ش��������⣺
(1)0-25min�ڣ���Ӧ��ƽ������v(H2)Ϊ_________������X=_________________��
(2)T��ʱ���÷�Ӧ��ƽ�ⳣ��K=_____________ ���������������
(3)T��ʱ������ʼ����8mol N2��24 mol H2����Ӧ�մﵽƽ��ʱ����ʾc( H2)����ͼ����Ӧ�ĵ�Ϊ_____������ĸ����
(4)��úΪ��Ҫԭ�ϵĺϳɰ���ҵ�У�ԭ����������������������ã�
��C(s) +H2O(g)![]() CO(g) +H2(g) ��H1
CO(g) +H2(g) ��H1
��CO(g) +H2O(g)![]() CO2(g) +H2(g) ��H2
CO2(g) +H2(g) ��H2
����֪CO��H2��ȼ���ȷֱ�Ϊ283 kJ��mol-l��285.8kJ��mol-l��H2O( g) =H2O(1) ��H =-44kJ��mol-l ���H2=_______________��
(5)�����������������Ҫԭ�ϣ���������£�
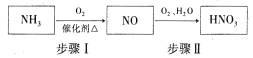
д������I�Ļ�ѧ����ʽ��_________________��
(6)��ͼ�ǿ�ѧ����������õ�ⷨ���³�ѹ���ɵ����������ϳɰ���ʾ��ͼ��
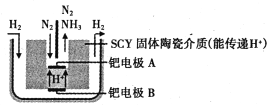
��ͼ��֪���ٵ缫B�ǵ��ص�________����������������������ٵ缫A�ϵĵ缫��ӦʽΪ________��