题目内容
【题目】合成氨是人类科学技术发展史上的一项重大突破,研究表明液氨是一种良好的储氢物质。
(1)化学家Gethard Ertl证实了氢气与氮气在固体催化剂表面合成氨的过程,示意如下图:
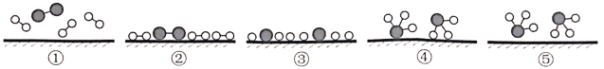
下列说法正确的是____(选填字母)。
A.①表示N2、H2分子中均是单键
B.②→③需要吸收能量
C.该过程表示了化学变化中包含旧化学键的断裂和新化学键的生成
(2)氨气分解反应的热化学方程式如下:2NH3(g)![]() N2(g)+3H2(g) △H,若N三N键、H一H键和N一H键的键能分别记作a、b和c(单位:kJ·mol-l),则上述反应的△H=___kJ·mol一1。
N2(g)+3H2(g) △H,若N三N键、H一H键和N一H键的键能分别记作a、b和c(单位:kJ·mol-l),则上述反应的△H=___kJ·mol一1。
(3)研究表明金属催化剂可加速氨气的分解。下表为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率(m mol.min一1)。
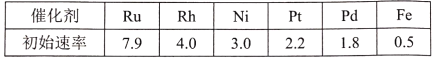
①不同催化剂存在下,氨气分解反应活化能最大的是___(填写催化剂的化学式)。
②温度为T,在一体积固定的密闭容器中加入2 molNH3,此时压强为P0,用Ru催化氨气分解,若平衡时氨气分解的转化率为50%,则该温度下反应2NH3(g)![]() N2(g)十3H2(g)用平衡分压代替平衡浓度表示的化学平衡常数Kp=___。[己知:气体分压(p分)=气体总压(p总)x体积分数]
N2(g)十3H2(g)用平衡分压代替平衡浓度表示的化学平衡常数Kp=___。[己知:气体分压(p分)=气体总压(p总)x体积分数]
(4)关于合成氨工艺的理解,下列正确的是___。
A.合成氨工业常采用的反应温度为500℃左右,可用勒夏特列原理解释
B.使用初始反应速率更快的催化剂Ru,不能提高平衡时NH3的产量
C.合成氨工业采用10 MPa一30 MPa,是因常压下N2和H2的转化率不高
D.采用冷水降温的方法可将合成后混合气体中的氨液化
(5)下图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3时,平衡混合物中氨的体积分数[![]() (NH3)]。
(NH3)]。
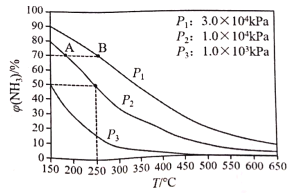
①若分别用vA(NH3)和vB(NH3)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(NH3)____vB(NH3)(填“>”、“<”或“=”)。
②在250℃、1.0×104kPa下,H2的转化率为______%(计算结果保留小数点后1位)。
(6)N2和H2在铁作催化剂作用下从145℃就开始反应,随着温度上升,单位时间内NH3产率增大,但温度高于900℃后,单位时间内NH3产率逐渐下降的原因________。
【答案】BC 6c-a-3b ![]()
![]() BC < 66.7 高于900℃后,产率受平衡移动影响为主,温度升高,平衡向左移动,NH3 产率下降
BC < 66.7 高于900℃后,产率受平衡移动影响为主,温度升高,平衡向左移动,NH3 产率下降
【解析】
⑴A. N2分子中是三键不是单键;
B. ②→③的过程是分子中价键断裂为原子,价键断裂是吸收能量的;
C. 化学变化的本质就是旧化学键的断裂,新化学键的生成。
⑵![]() ,根据反应方程式
,根据反应方程式![]() 计算;
计算;
⑶①根据碰撞理论的解释,催化剂的催化原理实质上是降低反应的活化能,活化能越低,则活化分子百分数越高,反应速率越大;
②
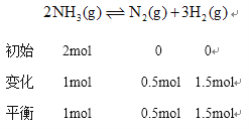
体积分数等于物质的量分数所以![]() 的体积分数为
的体积分数为![]() 、N2的体积分数为
、N2的体积分数为![]() 、
、![]() 的体积分数为
的体积分数为![]() ,根据同温同体积下,压强之比等于物质的量之比得总压强
,根据同温同体积下,压强之比等于物质的量之比得总压强![]() 化学平衡常数
化学平衡常数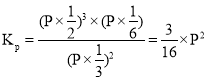 带入
带入![]() ,得
,得![]()
⑷A.反应为放热反应,按勒夏特列原理,应选择较低温度,此反应考虑到催化剂的活化温度;
B.催化剂的作用是增大反应速率,使反应尽快到到平衡,但不影响反应物转化率;
C. ![]() 反应是体积减小的反应,增大压强反应向右进行,增大转化率;
反应是体积减小的反应,增大压强反应向右进行,增大转化率;
D.氨气的沸点比水低,采用冷水降温的方法不能将合成后混合气体中的氨液化;
⑸①压强大,速率大,温度高,速率大;
② 初始时氮气、氢气的体积比为1:3时,假设![]() 为1 mol、
为1 mol、![]() 为3 mol, 设平衡时,
为3 mol, 设平衡时,![]() 消耗 x mol,再根据三段式法列式计算。
消耗 x mol,再根据三段式法列式计算。
⑹合成氨的反应是放热反应,当温度高于900℃后,产率受平衡移动影响为主,温度升高,平衡向左移动,NH3 产率下降;
⑴A.N2分子中是三键不是单键,故A错误;
B. ②→③的过程是分子中价键断裂为原子,价键断裂是吸收能量的,故需要吸收能量,故B正确;
C.化学变化的本质就是旧化学键的断裂,新化学键的生成,所以氢气与氮气在固体催化剂表面合成氨的过程表示了化学变化中包含旧化学键的断裂和新化学键的生成,故C正确;
故答案为:BC。
⑵![]() ,
,![]() 含有三个N-H键,根据反应方程式
含有三个N-H键,根据反应方程式![]() 可得
可得![]() ,故答案为:
,故答案为:![]() ;
;
⑶①Fe作催化剂时,氢气的初始生成速率最小,根据碰撞理论的解释,催化剂的催化原理实质上是降低反应的活化能,活化能越低,则活化分子百分数越高,反应速率越大,所以上述金属比较,铁作催化剂时,氨分解的活化能最大,故答案为:Fe;
②
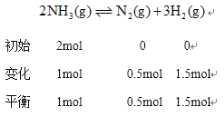
体积分数等于物质的量分数所以![]() 的体积分数为
的体积分数为![]() 、N2的体积分数为
、N2的体积分数为![]() 、
、![]() 的体积分数为
的体积分数为![]() ,根据同温同体积下,压强之比等于物质的量之比得总压强
,根据同温同体积下,压强之比等于物质的量之比得总压强![]() 化学平衡常数
化学平衡常数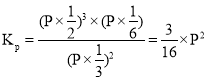 带入
带入![]() ,得
,得![]()
⑷A.反应为放热反应,按勒夏特列原理,应选择较低温度,此反应主要是考虑到催化剂的活化温度,故A错误;
B.催化剂的作用是增大反应速率,使反应尽快到到平衡,但不影响反应限度,故使用初始反应速率更快的催化剂Ru,不能提高平衡时NH3的产量,故B正确;
C. ![]() 反应是体积减小的反应,增大压强反应向右进行,所以合成氨工业压强采用10 MPa一30 MPa,可以大大增加转化率,故C正确;
反应是体积减小的反应,增大压强反应向右进行,所以合成氨工业压强采用10 MPa一30 MPa,可以大大增加转化率,故C正确;
D.氨气的沸点比水低,采用冷水降温的方法不能将合成后混合气体中的氨液化,故D错误;
故答案为BC;
⑸①压强大,速率快,温度高,速率快,B的温度比A的高,B的压强比A的大,所以B的速率大于A的速率,故答案为:<;
②初始时氮气、氢气的体积比为1:3时,假设![]() 为1mol、
为1mol、![]() 为3mol,设平衡时,
为3mol,设平衡时,![]() 消耗xmol
消耗xmol

由图可知在250℃、1.0×104kPa下,平衡混合物中氨的体积分数为50%,列式
![]() ,解得
,解得![]() ,
,![]() 的转化率为
的转化率为![]() ,故答案为:66.7%;
,故答案为:66.7%;
⑹合成氨的反应是放热反应,当温度高于900℃后,产率受平衡移动影响为主,温度升高,平衡向左移动,NH3 产率下降,故答案为:高于900℃后,产率受平衡移动影响为主,温度升高,平衡向左移动,NH3 产率下降;