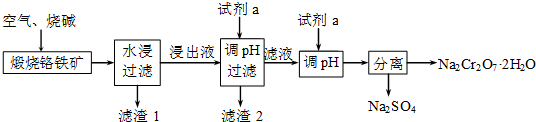
题目内容
2.碘是生命体中的必需元素,请根据如下有关碘及其化合物的性质,回答下列问题:(1)实验室中制取少量碘可采用如下方法:KI+CuSO4→A (白色)↓+K2SO4+I2.
16.0g CuSO4与过量KI反应后可得19.1g 的A,写出A的化学式:CuI.工业生产中,可用智利硝石(含有NaIO3)为原料,与NaHSO3反应后生成碘,写出此反应的离子方程式:2IO3-+5HSO3-=3H++5SO42-+I2+H2O.
(2)单质碘与氟气反应可得IF5,实验表明液态IF5具有一定的导电性,研究人员发现产生这一现象的可能原因在于IF5的自偶电离(如:2H2O?H3O++OH-),生成的阳离子为IF4+;阴离子为IF6-.
(3)将单质碘与铝屑置于管式电炉中,隔绝空气加热至500℃得到棕色片状固体,此固体溶于Na2CO3溶液可产生白色沉淀和气体.请写出上述实验过程中发生的化学反应方程式:2Al+3I2=2AlI3,2AlI3+3Na2CO3+3H2O=2Al(OH)3↓+6NaI+3CO2↑.
(4)某化学课外小组用海带为原料制得少量含碘离子的溶液.现用0.10mol•L-1的酸性高锰酸钾溶液滴定20.00mL该溶液需10.25mL,则该溶液中碘离子的浓度为0.26mol•L-1(精确到0.01).
(5)I2O5是白色粉末状固体,可用作氧化剂使H2S、CO、HC1等氧化,在合成氨工业中常用I2O5来定量测量CO的含量.已知:
2I2(s)+5O2(g)=2I2O5(s)△H=-75.56kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
写出CO(g)与I2O5(s)反应析出固态I2的热化学方程式:5CO(g)+I2O5(s)=5CO2(g)+I2(s)△H=-1377.22kJ•mol-1.
分析 (1)根据元素守恒知,A中含有Cu元素,该反应中I元素化合价由-1价变为0价,Cu元素得电子化合价降低,白色沉淀是Cu和I元素形成的化合物,n(CuSO4)=$\frac{16.0g}{160g/mol}$=0.1mol,m(Cu)=64g/mol×0.1mol=6.4g,A中n(I)=$\frac{19.1g-6.4g}{127g/mol}$=0.1mol,n(Cu):n(I)=0.1mol:0.1mol=1:1,据此判断A化学式;碘酸根离子和亚硫酸根离子发生氧化还原反应生成硫酸根离子、碘、氢离子和水;
(2)根据水的电离方程式确定IF5电离方程式,从而确定其阴离子;
(3)AlI3属于强酸弱碱盐、Na2CO3属于强碱弱酸盐,二者发生双水解反应生成氢氧化铝和二氧化碳;
(4)根据高锰酸钾和碘离子之间的关系式计算碘离子的物质的量浓度;
(5)根据已知热化学方程式,利用盖斯定律计算和书写热化学方程式.
解答 解:(1)根据元素守恒知,A中含有Cu元素,该反应中I元素化合价由-1价变为0价,Cu元素得电子化合价降低,白色沉淀是Cu和I元素形成的化合物,n(CuSO4)=$\frac{16.0g}{160g/mol}$=0.1mol,m(Cu)=64g/mol×0.1mol=6.4g,A中n(I)=$\frac{19.1g-6.4g}{127g/mol}$=0.1mol,n(Cu):n(I)=0.1mol:0.1mol=1:1,则A化学式为CuI;
碘酸根离子和亚硫酸根离子发生氧化还原反应生成硫酸根离子、碘、氢离子和水,离子方程式为2IO3-+5HSO3-=3H++5SO42-+I2+H2O,
故答案为:CuI;2IO3-+5HSO3-=3H++5SO42-+I2+H2O;
(2)根据水的电离方程式知,IF5电离方程式为2IF5?IF4++IF6-,所以生成的阳离子为IF4+,阴离子为IF6-,
故答案为:IF4+;IF6-;
(3)将单质碘与铝屑置于管式电炉中,隔绝空气加热碘单质和铝反应生成碘化铝,AlI3属于强酸弱碱盐、Na2CO3属于强碱弱酸盐,二者发生双水解反应生成氢氧化铝和二氧化碳,方程式为:2Al+3I2=2AlI3,2AlI3+3Na2CO3+3H2O=2Al(OH)3↓+6NaI+3CO2↑,
故答案为:2Al+3I2=2AlI3;2AlI3+3Na2CO3+3H2O=2Al(OH)3↓+6NaI+3CO2↑;
(4)反应消耗的高锰酸钾的物质的量为:0.10mol•L-1×0.01025L=0.001025mol,设参加反应的碘离子的物质的量为nmol,
2MnO4-+10I-+16H+=2Mn2++5I2 +8H2O
2 10
0.001025mol n
则$\frac{2}{0.001025mol}$=$\frac{10}{n}$,解得:n=0.005125mol,所以c(I-)=$\frac{n}{V}$=$\frac{0.005125mol}{0.02L}$=0.26mol•L-1,
故答案为:0.26;
(5)已知热化学方程式:
2 I2(s)+5O2(g)=2 I2O5(s);△H=-75.56kJ•mol-1①,
2CO(g)+O2(g)=2 CO2(g);△H=-566.0kJ•mol-1②,
根据盖斯定律将方程式②×$\frac{5}{2}$-①×$\frac{1}{2}$得5CO(g)+I2O5(s)=5 CO2(g)+I2(s);△H=(-566.0kJ•mol-1)×$\frac{5}{2}$-(-75.56kJ•mol-1)×$\frac{1}{2}$=-1377.22kJ/mol,
所以其热化学反应方程式为:5CO(g)+I2O5(s)=5 CO2(g)+I2(s)△H=-1377.22kJ/mol,
故答案为:5CO(g)+I2O5(s)=5 CO2(g)+I2(s)△H=-1377.22kJ/mol.
点评 本题考查碘元素及其化合物的性质,侧重考查性质实验方案设计,涉及离子检验、双水解反应、弱电解质的电离等知识点,明确物质性质是解本题关键,会利用已知知识采用知识迁移方法解答问题,题目难度中等.

| A. | 氯气是既不是电解质,也不是非电解质,但其水溶液却可以导电 | |
| B. | Al2O3和MgO都是属于离子化合物,熔沸点都很高,故工业上常用熔点较低的AlCl3和MgCl2来冶炼金属 | |
| C. | H2O是分子晶体,晶体中含氢键,其熔沸点一般比同主族的氢化物要高 | |
| D. | 分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 |
| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA | |
| C. | 欲配制1.00L 1.00mol•L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中 | |
| D. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA |
| A. | 常温常压下,8gO2含有4NA个电子 | |
| B. | 1molN2与过量H2反应,转移6NA个电子 | |
| C. | 1L1.0mo1/L的Na2SO4水溶液中含有的氧原子数为4NA | |
| D. | 1L0.1mol/L的氨水中有NA个NH4+ |
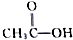 、
、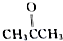 及
及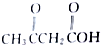 .根据上述事实推测A可能的构造式.
.根据上述事实推测A可能的构造式.