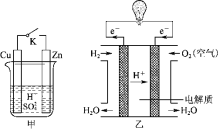
题目内容
【题目】根据表中提供的数据,下列判断正确的是
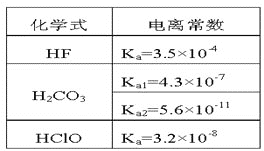
A.同温同浓度下,溶液的pH:NaF>NaClO>Na2CO3
B.结合H+的能力:ClO->CO32->F-
C.次氯酸钠溶液中通少量二氧化碳的离子方程式:ClO-+H2O+CO2=HClO+HCO3-
D.碳酸钠溶液中加入少量氢氟酸的离子方程式:CO32-+2HF=2F-+H2O+CO2↑
【答案】C
【解析】
弱酸的电离平衡常数越大,酸性越强,弱酸的电离平衡常数越小,酸性越弱,其酸根结合氢离子的能力越强,其对应的盐水解程度越大,强酸可以制弱酸。
据表格分析,酸性由强到弱的顺序为:HF、H2CO3、HClO。
A.酸性由强到弱的顺序为:HF、H2CO3、HClO,酸性越弱,其酸根水解结合氢离子的能力就越强,溶液的碱性越强,所以溶液pH:Na2CO3>NaClO>NaF,A错误;
B.酸性由强到弱的顺序为:HF、H2CO3、HClO,酸性越弱,其相应的酸根离子结合H+的能力就越强,所以结合H+的能力:CO32->ClO->F-,B错误;
C.碳酸的第一步电离酸性比次氯酸强,所以向次氯酸钠溶液中通少量二氧化碳的离子方程式可以发生反应,ClO-+CO2+H2O=HCO3-+HClO,C正确;
D.向碳酸钠溶液中加入少量氢氟酸时,先水解生成碳酸氢根离子,离子方程式为:CO32-+HF=F-+HCO3-,D错误;
故合理选项是C。

练习册系列答案
相关题目