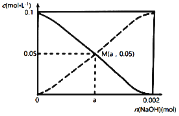
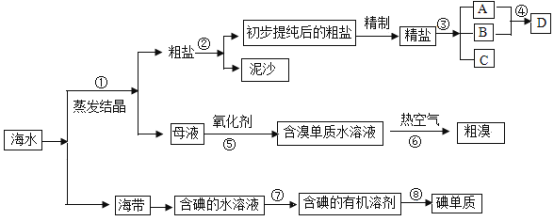
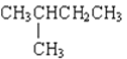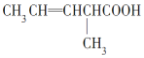题目内容
【题目】根据碘与氢气反应的热化学方程式:
(i)I2(g)+H2(g) ![]() 2HI(g)+9.48kJ (ii)I2(s)+H2(g)
2HI(g)+9.48kJ (ii)I2(s)+H2(g)![]() 2HI(g)-26.48kJ
2HI(g)-26.48kJ
下列判断正确的是( )
A.![]() 中通入
中通入![]() ,反应放热
,反应放热![]()
B.![]() 固态碘与
固态碘与![]() 气态碘所含的能量相差
气态碘所含的能量相差![]()
C.反应(i)的产物比反应(ii)的产物稳定
D.反应(ii)的反应物总能量比反应(i)的反应物总能量低
【答案】D
【解析】
A、因为是可逆反应,所以1molI2(g)与1molH2(g) 不能进行完全,故放热小于9.48kJ,故A错误;
B、由盖斯定律知(i)-(ii)得![]() ,故1mol固态碘与1mol气态碘所含的能量相差35.96kJ,故B错误;
,故1mol固态碘与1mol气态碘所含的能量相差35.96kJ,故B错误;
C、反应(i)、反应(ii)的产物都是HI(g),状态相同,稳定性一样,故C错误;
D、对于同一物质,固态物质的能量比气态物质能量低,故反应(ii)的反应物总能量比反应(i)的反应物总能量低,故D正确;
答案选D。

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目