题目内容
13.下列离子方程式书写正确的是( )| A. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O | |
| B. | 淀粉碘化钾溶液在空气中变蓝:4I-+O2+2H2O=4OH-+2I2 | |
| C. | 磁性氧化铁溶于盐酸:Fe2O3+6H+=2Fe3++3H2O | |
| D. | 用氨水吸收足量的SO2气体:OH-+SO2=HSO3- |
分析 A.氢离子和氢氧根离子的系数错误,不满足氢氧化钡和硫酸的化学式组成;
B.空气中氧气将碘离子氧化成碘单质,碘单质遇到淀粉显示蓝色;
C.磁性氧化铁为四氧化三铁,与盐酸反应生成亚铁离子和铁离子;
D.氨水为弱碱,离子方程式中一水合氨不能拆开.
解答 解:A.氢氧化钡溶液与稀硫酸反应生成硫酸钡沉淀和水,正确的离子方程式为:Ba2++SO42-+2H++2OH-=BaSO4↓+2H2O,故A错误;
B.氧气能够氧化碘离子,则淀粉碘化钾溶液在空气中变蓝,反应的离子方程式为:4I-+O2+2H2O=4OH-+2I2,故B正确;
C.磁性氧化铁溶于盐酸,反应生成氯化铁和氯化亚铁,正确的离子方程式为:Fe3O4+8H+=2Fe3++Fe2++4H2O,故C错误;
D.氨水吸收足量SO2,反应生成亚硫酸氢铵,正确的离子方程式为:NH3•H2O+SO2=NH4++HSO3-,故D错误;
故选B.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意掌离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.X、Y、Z、W、M为原子序数依次增大的短周期主族元素.已知①元素对应的原子半径大小为:X<Z<Y<M<W ②原子的最外层电子数:X=W,X+Y=Z=2M ③Y元素的主要化合价:最高正价+最低负价=2,下列说法不正确的是( )
| A. | X、Z两种元素可形成X2Z和X2Z2两种常见共价化合物 | |
| B. | M与Z形成的化合物的分子式为M2Z3 | |
| C. | 工业上可用电解熔融的W的氯化物的方法制取W的单质 | |
| D. | Z元素对应的单质与W元素对应的单质在不同条件下反应产物可能不同 |
1.下列说法中正确的是( )
| A. | 标准状况下,11.2L CCl4所含分子数为0.5NA | |
| B. | 56g Fe与足量的盐酸反应转移电子数为3NA | |
| C. | 1mol铁元素转化成氢氧化铁胶体后,便有NA个氢氧化铁胶体微粒 | |
| D. | 常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NA |
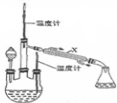 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl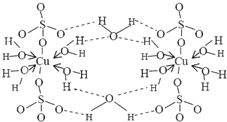 波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料.胆矾CuSO4?5H2O可写成[Cu(H2O)4]SO4?H2O,其结构示意图如图:
波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料.胆矾CuSO4?5H2O可写成[Cu(H2O)4]SO4?H2O,其结构示意图如图: ,与铜同周期的所有元素的基态原子中最外层电子数与铜原子相同的元素有K、Cr(填元素符号).
,与铜同周期的所有元素的基态原子中最外层电子数与铜原子相同的元素有K、Cr(填元素符号).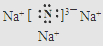 .
.


 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$
 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +2H2O.
+2H2O.