题目内容
【题目】用惰性电极电解1.0 L c(Cl-)=3.0 mol/L的CuCl2、NaCl混合溶液,一段时间后,两极均收集到56.0 L的气体(标准状况下)。下列说法正确的是( )
A.阳极只收集到Cl2
B.电解前溶液呈弱酸性,电解结束后,溶液的酸性增强
C.整个过程中共转移电子5 mol
D.原混合溶液中c(Cu2+)=1.0 mol/L
【答案】D
【解析】
用惰性电极电解1.0 L c(Cl-)=3.0 mol/L的CuCl2、NaCl混合溶液,一段时间后,两极均收集到56.0L的气体(标准状况下),气体物质的量为![]() ,
,![]() ,则阳极上Cl-先放电生成氯气,
,则阳极上Cl-先放电生成氯气,![]() ,则Cl-放电后,OH-放电,且生成氧气1mol;阴极上Cu2+先放电,然后H+放电,且生成氢气2.5mol,再根据阴阳两极得失电子守恒进行计算。
,则Cl-放电后,OH-放电,且生成氧气1mol;阴极上Cu2+先放电,然后H+放电,且生成氢气2.5mol,再根据阴阳两极得失电子守恒进行计算。
A. 经分析知,阳极收集到气体共2.5mol,而溶液中Cl-共3mol,生成氯气共1.5mol,则Cl-放电后,OH-放电,且生成氧气1mol,A项错误;
B. 经分析可知,整个电解过程应分为三个阶段:CuCl2![]() Cu+Cl2↑,2NaCl+2H2O
Cu+Cl2↑,2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,2H2O
2NaOH+H2↑+Cl2↑,2H2O![]() H2↑+O2↑,电解结束后,溶液的碱性增强,B项错误;
H2↑+O2↑,电解结束后,溶液的碱性增强,B项错误;
C. 经分析知,阳极生成氯气1.5mol,则Cl-放电后,OH-放电,且生成氧气1mol,则阳极失电子总物质的量为:![]() ,则整个过程中共转移电子7 mol,C项错误;
,则整个过程中共转移电子7 mol,C项错误;
D. 根据得失电子守恒知,阴极得电子数等于阳极失电子数,则阴极得电子物质的量为7mol,经计算阴极生成氢气为2.5mol,那么H+得电子物质的量为5mol,则Cu2+得电子物质的量为2mol,n(Cu2+)=1.0 mol,原混合溶液中![]() ,D项正确;
,D项正确;
答案选D。

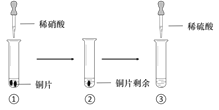
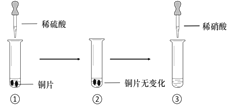
【题目】某同学进行有关铜、硝酸、硫酸化学性质的实验,实验过程如图所示:
实验1 | 实验2 |
|
|
①、③中溶液呈蓝色,试管口有红棕色气体产生 | ③中溶液呈蓝色,试管口有红棕色气体产生 |
下列说法正确的是
A. 稀硝酸一定被还原为NO2
B. 实验1-②中溶液存在:c(Cu2+) + c(H+) =c(NO3-) + c(OH-)
C. 由上述实验得出结论:常温下,Cu既可与稀硝酸反应,也可与稀硫酸反应
D. 实验1-③、实验2-③中反应的离子方程式:3Cu+2NO3-+8H+ =3Cu2++2NO↑+4H2O