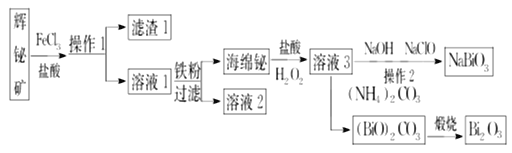
题目内容
【题目】硅及其化合物在材料领域中应用广泛。回答下列问题:
(1)硅单质有晶体硅和无定形硅两种,区别晶体硅和无定形硅的科学方法是___________
(2)基态硅的价电子排布式为_________,其核外电子的运动状态有_____种。
(3)CCl4和SiCl4常温下均呈液态,SiCl4熔沸点较高的原因为________CCl4不水解,但SiCl4遇水即强烈水解,则SiCl4水解的化学方程式为__________。
(4)SiF4的热稳定性比SiCl4强的原因是 ____。
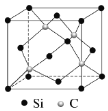
(5)碳化硅(SiC)的结构与金刚石类似,碳化硅的硬度仅次于金刚石,其晶胞结构如图所示。则Si原子的配位数为_______,若晶体的密度为ρg/cm3![]() ,阿伏伽德罗常数为NA,则距离最近的Si原子与C原子之间的距离为_______________cm。(用ρ和NA的式子表示)
,阿伏伽德罗常数为NA,则距离最近的Si原子与C原子之间的距离为_______________cm。(用ρ和NA的式子表示) ![]()
【答案】X—射线衍射实验 3s23p2 14 CCl4和SiCl4均为分子晶体,SiCl4相对分子质量大,范德华力大,熔沸点高 SiCl4 + 3H2O = H2SiO3 + 4HCl F原子半径小与Cl原子,故SiF4键能大于SiCl4 4 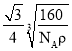
【解析】
(1)区别晶体硅和无定形硅的科学方法是X—射线衍射实验;
(2)硅为14号元素,其基态硅原子的价电子排布式为3s23p2 ;原子核外有多少个电子就有多少种运动状态;
(3)根据分子晶体熔沸点的比较进行解答;根据SiCl4遇水强烈水解写出反应方程式;
(4)根据原子半径越小,键长越短,则键能越大,则分子越稳定进行分析;
(5)每个Si原子周围距离相等且最近的C原子的个数即是Si原子的配位数;先计算晶胞的质量,再计算晶胞的边长,再根据距离最近的Si原子与C原子之间的距离为体对角线的![]() ,计算最近距离。
,计算最近距离。
(1)硅单质有晶体硅和无定形硅两种,区别晶体硅和无定形硅的科学方法是X—射线衍射实验;
故答案为:X—射线衍射实验;
(2)硅为14号元素,其基态硅的价电子排布式为3s23p2 ;其核外电子的运动状态有14种;
故答案为:3s23p2 ;14;
(3)CCl4和SiCl4常温下均呈液态,SiCl4熔沸点较高的原因为CCl4和SiCl4均为分子晶体,SiCl4相对分子质量大,范德华力大,熔沸点高;SiCl4遇水强烈水解,则SiCl4水解的化学方程式为SiCl4 + 3H2O == H2SiO3 + 4HCl;
故答案为:CCl4和SiCl4均为分子晶体,SiCl4相对分子质量大,范德华力大,熔沸点高;SiCl4 + 3H2O == H2SiO3 + 4HCl;
(4)SiF4的热稳定性比SiCl4强是因为F原子半径比Cl原子半径小,SiF4键能比SiCl4的键能大,则SiF4的热稳定性比SiCl4强;
故答案为:F原子半径比Cl原子半径小,SiF4键能比SiCl4的键能大,则SiF4的热稳定性比SiCl4强;
(5)根据晶胞结构图可知每个Si原子周围有4个C原子,则Si原子的配位数为4;晶体的密度为ρg/cm3![]() ,阿伏伽德罗常数为NA,每个晶胞中有4个Si原子,4个C原子,则晶胞的质量为
,阿伏伽德罗常数为NA,每个晶胞中有4个Si原子,4个C原子,则晶胞的质量为![]() ,则晶胞的边长为
,则晶胞的边长为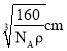 ,距离最近的Si原子与C原子之间的距离为体对角线的
,距离最近的Si原子与C原子之间的距离为体对角线的![]() ,则距离最近的Si原子与C原子之间的距离为
,则距离最近的Si原子与C原子之间的距离为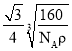 cm;
cm;
故答案为:4;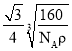 。
。

 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案