题目内容
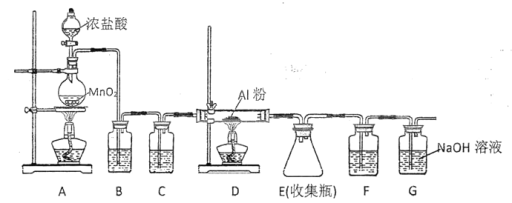
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如图所示。
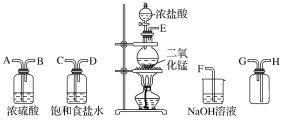
(1)连接上述仪器的正确顺序(填各接口处的字母):__接__;__接__;__接___;__接__。
(2)装置中,饱和食盐水的作用是___;NaOH溶液的作用是___。
(3)化学实验中常用湿润的KI-淀粉试纸检验是否有Cl2产生。如果有Cl2产生,可观察到___,反应的化学方程式为___。
(4)写出下列反应的化学方程式:
①气体发生装置中进行的反应:___。
②NaOH溶液中发生的反应:___。
【答案】E C D A B H G F 除去氯气中的HCl杂质 吸收过量的氯气 吸收过量的氯气 2KI+Cl2=2KCl+I2 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 2NaOH+Cl2=NaCl+NaClO+H2O
MnCl2+Cl2↑+2H2O 2NaOH+Cl2=NaCl+NaClO+H2O
【解析】
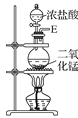 为氯气的制备装置,装置中二氧化锰和浓盐酸共热反应生成氯化锰、氯气和水,浓盐酸具有挥发性,选用装置
为氯气的制备装置,装置中二氧化锰和浓盐酸共热反应生成氯化锰、氯气和水,浓盐酸具有挥发性,选用装置 除去氯气中混有的氯化氢,选用装置
除去氯气中混有的氯化氢,选用装置 干燥氯气,氯气的密度比空气大,选用装置
干燥氯气,氯气的密度比空气大,选用装置![]() 从H口通入收集氯气,氯气有毒,选用装置
从H口通入收集氯气,氯气有毒,选用装置![]() 吸收氯气,防止污染环境。
吸收氯气,防止污染环境。
(1)制备干燥纯净的氯气,实验装置的连接顺序为:发生装置→除杂装置→干燥装置→收集装置→尾气处理装置,注意除杂装置中长导管进气,短导管出气,氯气的密度大于空气,收集时应长导管进气短导管出气,则仪器连接的顺序为E—C—D—A—B—H—G—F,故答案为:E;C;D;A;B;H;G;F;
(2)氯气中混有氯化氢杂质,氯化氢能溶于饱和食盐水中,但是氯气不溶,可以用饱和食盐水除去氯气中的氯化氢气体;氯气有毒,NaOH溶液的作用是吸收过量的氯气,防止污染环境,故答案为:除去氯气中的HCl杂质;吸收过量的氯气;
(3)Cl2氧化KI生成碘,碘单质遇淀粉变蓝,故观察到的现象为试纸变蓝,反应的化学方程式为2KI+Cl2=2KCl+I2,故答案为:试纸变蓝;2KI+Cl2=2KCl+I2;
(4)①气体发生装置中二氧化锰和浓盐酸共热反应生成氯化锰、氯气和水,反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
②NaOH溶液与氯气反应生成氯化钠、次氯酸钠和水,反应的化学方程式为2NaOH+Cl2=NaCl+NaClO+H2O,故答案为:2NaOH+Cl2=NaCl+NaClO+H2O。

【题目】研究硫元素及其化合物的性质具有重要意义。
(1)25 ℃,在0.10 mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与[S2-]关系如下图(忽略溶液体积的变化、H2S的挥发)。
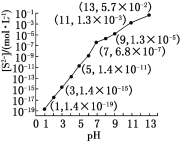
①pH=13时,溶液中的[H2S]+[HS-]=__________mol·L-1。
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH=____________时,Mn2+开始沉淀[已知:Ksp(MnS)=2.8×10-13]。
(2)25 ℃,两种酸的电离平衡常数如下表。
物质 | Ka1 | Ka2 |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO的电离平衡常数表达式K=________。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为____________________。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为_________________________。