题目内容
【题目】研究硫元素及其化合物的性质具有重要意义。
(1)25 ℃,在0.10 mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与[S2-]关系如下图(忽略溶液体积的变化、H2S的挥发)。
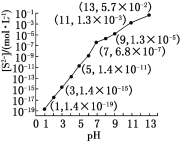
①pH=13时,溶液中的[H2S]+[HS-]=__________mol·L-1。
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH=____________时,Mn2+开始沉淀[已知:Ksp(MnS)=2.8×10-13]。
(2)25 ℃,两种酸的电离平衡常数如下表。
物质 | Ka1 | Ka2 |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO的电离平衡常数表达式K=________。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为____________________。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为_________________________。
【答案】0.0435![]() [Na+]>[
[Na+]>[![]() ]>[OH-]>[
]>[OH-]>[![]() ]>[H+]H2SO3+
]>[H+]H2SO3+![]() ===
===![]() +CO2↑+H2O
+CO2↑+H2O
【解析】
(1)①根据物料守恒:[S2-]+[H2S]+[HS-]=0.10 mol·L-1,故[H2S]+[HS-]=0.10 mol·L-1-[S2-]=0.10 mol·L-1-5.7×10-2mol·L-1=0.043 mol·L-1。②要使Mn2+沉淀,需要的[S2-]最小值为[S2-]=![]() =
=![]() =1.4×10-11,再对照图象找出pH=5,故答案为:①0.043②5;(2)①电离平衡常数等于电离出的离子平衡浓度的系数次幂的乘积与弱电解质的平衡浓度的比值,则HSO的电离平衡常数表达为
=1.4×10-11,再对照图象找出pH=5,故答案为:①0.043②5;(2)①电离平衡常数等于电离出的离子平衡浓度的系数次幂的乘积与弱电解质的平衡浓度的比值,则HSO的电离平衡常数表达为![]() ;②SO
;②SO![]() 发生水解,生成HSO
发生水解,生成HSO![]() 和OH-,HSO
和OH-,HSO![]() 再进一步水解生成H2SO3和OH-,故离子浓度大小关系为[Na+]>[SO
再进一步水解生成H2SO3和OH-,故离子浓度大小关系为[Na+]>[SO![]() ]>[OH-]>[HSO
]>[OH-]>[HSO![]() ]>[H+]。③由表中电离平衡常数可得如下关系:Ka1(H2SO3)>Ka1(H2CO3)>Ka2(H2SO3)>Ka2(H2CO3),则反应可放出CO2气体,同时生成HSO
]>[H+]。③由表中电离平衡常数可得如下关系:Ka1(H2SO3)>Ka1(H2CO3)>Ka2(H2SO3)>Ka2(H2CO3),则反应可放出CO2气体,同时生成HSO![]() ,故答案为:
,故答案为:![]() 、[Na+]>[SO
、[Na+]>[SO![]() ]>[OH-]>[HSO
]>[OH-]>[HSO![]() ]>[H+]、H2SO3+HCO
]>[H+]、H2SO3+HCO![]() ===HSO
===HSO![]() +CO2↑+H2O。
+CO2↑+H2O。

 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案
