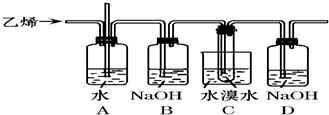
题目内容
分别取50mL的0.50mol?L-1盐酸与50mL 0.55mol?L-1氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.
(1)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、量筒、
(2)为什么在中和热测定中要用稍过量的碱:
(3)用浓硫酸代替盐酸溶液进行上述实验,测得的中和热的数值会 (填“偏大”、“偏小”、“无影响”),理由:
(4)若在实验过程中,不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H -57.3kJ?mol-1(填“>”、“<”或“=”).
(1)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、量筒、
(2)为什么在中和热测定中要用稍过量的碱:
(3)用浓硫酸代替盐酸溶液进行上述实验,测得的中和热的数值会
(4)若在实验过程中,不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H
考点:中和热的测定
专题:化学反应中的能量变化
分析:(1)根据量热计的构造和实验步骤来确定实验的仪器;
(2)在实验中,为了保证酸(或碱)能够完全被中和,往往使得另一方过量;
(3)浓硫酸在稀释过程中会放出大量的热量;
(4)酸和碱之间因为中和反应放热温度升高.
(2)在实验中,为了保证酸(或碱)能够完全被中和,往往使得另一方过量;
(3)浓硫酸在稀释过程中会放出大量的热量;
(4)酸和碱之间因为中和反应放热温度升高.
解答:
解:(1)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、搅拌器以及量筒;
故答案为:环形玻璃搅拌棒;
(2)在中和热测定的实验中,为了保证酸(或碱)能够完全被中和,往往使得另一方过量;
故答案为:为了保证酸(或碱)能够完全被中和或通过测量值求算的是反应生成1mol水时的反应热即中和热;
(3)浓硫酸在稀释过程中会放出大量的热量,导致中和热的数值会偏高;
故答案为:偏大,浓硫酸稀释过程中会放热;
(4)若在实验过程中,不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,酸和碱会发生酸和碱的中和,温度计示数变化值减小,所以导致实验测得中和热的数值偏小,但反应热△H>-57.3KJ/mol;
故答案为:>.
故答案为:环形玻璃搅拌棒;
(2)在中和热测定的实验中,为了保证酸(或碱)能够完全被中和,往往使得另一方过量;
故答案为:为了保证酸(或碱)能够完全被中和或通过测量值求算的是反应生成1mol水时的反应热即中和热;
(3)浓硫酸在稀释过程中会放出大量的热量,导致中和热的数值会偏高;
故答案为:偏大,浓硫酸稀释过程中会放热;
(4)若在实验过程中,不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,酸和碱会发生酸和碱的中和,温度计示数变化值减小,所以导致实验测得中和热的数值偏小,但反应热△H>-57.3KJ/mol;
故答案为:>.
点评:本题为有关中和热测定的实验知识考题,考查学生分析和解决问题的能力,难度不大.

练习册系列答案
相关题目
下列物质能使品红溶液褪色的是( )
①活性炭②过氧化钠③氯水④二氧化硫⑤臭氧.
①活性炭②过氧化钠③氯水④二氧化硫⑤臭氧.
| A、①③④ | B、②④⑤ |
| C、①②③④ | D、①②③④⑤ |
下列叙述中,不正确的是( )
| A、热稳定性:Na2CO3比NaHCO3稳定 |
| B、溶解性:Na2CO3比NaHCO3易溶于水(同一条件下) |
| C、相同质量的Na2CO3和NaHCO3分别与足量的稀盐酸充分反应后,Na2CO3放出CO2多 |
| D、用FeCl3溶液腐蚀印刷电路板Cu+2Fe3+═Cu2++2Fe2+ |
 与
与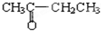 ;B.
;B.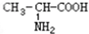 与
与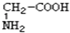 ;C.
;C.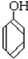 与
与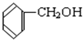 ;D.
;D. 与
与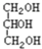 ;E.
;E.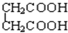 与
与 ;F.戊烯和环戊烯.
;F.戊烯和环戊烯.