题目内容
A. 与
与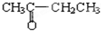 ;B.
;B.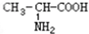 与
与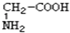 ;C.
;C.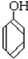 与
与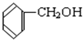 ;D.
;D. 与
与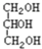 ;E.
;E.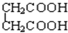 与
与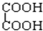 ;F.戊烯和环戊烯.
;F.戊烯和环戊烯.
(1)上述各化合物中,属于同系物的是 ,属于同分异构体的是 (填入编号).
(2)某芳香烃的分子式是C8H10,它可能有的同分异构体共有 种,其中 、 (写结构简式)在苯环上的一溴代物有三种.
(3)甲苯与浓硝酸反应的化学方程式为 .反应类型为 .此反应的产物中属于有机物的物质用系统命名法命名为 .
(4)某烃类化合物A的相对分子质量为84,分子中含有一个碳碳双键,其分子核磁共振氢谱只有一个吸收峰.则A的结构简式为 .
(5)写出下列基团(或官能团)的名称或结构简式:-CH2CH3 、异丙基: 、碳碳双键 .
(6)某烯烃与H2发生加成反应后得到的产物是CH3CH(CH3)2.则原来烯烃的结构简式为 .
 与
与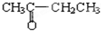 ;B.
;B.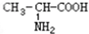 与
与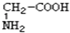 ;C.
;C. 与
与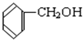 ;D.
;D. 与
与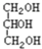 ;E.
;E.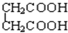 与
与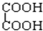 ;F.戊烯和环戊烯.
;F.戊烯和环戊烯.(1)上述各化合物中,属于同系物的是
(2)某芳香烃的分子式是C8H10,它可能有的同分异构体共有
(3)甲苯与浓硝酸反应的化学方程式为
(4)某烃类化合物A的相对分子质量为84,分子中含有一个碳碳双键,其分子核磁共振氢谱只有一个吸收峰.则A的结构简式为
(5)写出下列基团(或官能团)的名称或结构简式:-CH2CH3
(6)某烯烃与H2发生加成反应后得到的产物是CH3CH(CH3)2.则原来烯烃的结构简式为
考点:芳香烃、烃基和同系物,有机物分子中的官能团及其结构,同分异构现象和同分异构体
专题:同系物和同分异构体,有机物的化学性质及推断
分析:(1)同系物是指结构相似,组成上相差CH2原子团的物质互称同系物;同分异构体是分子式相同,结构不同的物质互为同分异构体;依据概念分析各物质;
(2)分子式为C8H10的芳香烃的同分异构体有乙基苯、邻二甲苯、间二甲苯、对二甲苯,总共4种;其中苯环上的一溴取代物有3种同分异构体,说明该苯的同系物中苯环上含有3种等效H原子,结合各有机物结构简式进行判断即可;
(3)甲苯与浓硫酸和浓硝酸的混酸加热反应生成三硝基甲苯和水,发生的是取代反应;根据系统命名法对三硝基甲苯进行命名;
(4)含有1个碳碳双键的烃为烯烃,分子核磁共振氢谱只有一个吸收峰,分子内所有氢原子都处于相同的化学环境,所有的氢原子是完全对称等效的;
(5)结合常见的烃基、官能团的名称和结构简式解答;
(6)在烷烃CH3-CH(CH3)2的碳架上添加碳碳双键就可以得到原烯烃的结构简式.
(2)分子式为C8H10的芳香烃的同分异构体有乙基苯、邻二甲苯、间二甲苯、对二甲苯,总共4种;其中苯环上的一溴取代物有3种同分异构体,说明该苯的同系物中苯环上含有3种等效H原子,结合各有机物结构简式进行判断即可;
(3)甲苯与浓硫酸和浓硝酸的混酸加热反应生成三硝基甲苯和水,发生的是取代反应;根据系统命名法对三硝基甲苯进行命名;
(4)含有1个碳碳双键的烃为烯烃,分子核磁共振氢谱只有一个吸收峰,分子内所有氢原子都处于相同的化学环境,所有的氢原子是完全对称等效的;
(5)结合常见的烃基、官能团的名称和结构简式解答;
(6)在烷烃CH3-CH(CH3)2的碳架上添加碳碳双键就可以得到原烯烃的结构简式.
解答:
解:(1)A、丁醛和丁酮分子式相同结构不同,属于同分异构体;
B、官能团相同,组成相差CH2,属于同系物;
C、表示的是苯酚和苯甲醇,是本题类物质;不属于同系物、同分异构体;
D、官能团类型相同,数目不同,属于不同类醇,不是同系物,同分异构体;
E、官能团相同是二元酸,分子组成相差CH2,是同系物;
F、戊烯和环戊烷分子式相同,结构不同,属于同分异构体;
综上所述:属于同系物的是BE;属于同分异构体的是:AF;
故答案为:BE;AF;
(2)芳香烃的分子式是C8H10,它可能有的同分异构体为: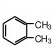 、
、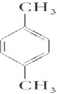 、
、 、
、 ,总共有4种;
,总共有4种;
苯环上的一溴取代物有3种同分异构体,说明该苯的同系物中苯环上含有3种等效H原子,
乙苯 苯环上有3种不同氢原子,所以苯环上的一溴取代物有3种,
苯环上有3种不同氢原子,所以苯环上的一溴取代物有3种,
邻二甲苯 的苯环上有2种不同氢原子,所以苯环上的一溴取代物有2种,
的苯环上有2种不同氢原子,所以苯环上的一溴取代物有2种,
对二甲苯的结构简式为: ,其苯环上有1种氢原子,所以苯环上的一溴取代物只有1种,
,其苯环上有1种氢原子,所以苯环上的一溴取代物只有1种,
间二甲苯 的苯环上只有3种氢原子,所以苯环上的一溴取代物有3种,
的苯环上只有3种氢原子,所以苯环上的一溴取代物有3种,
所以在苯环上的一溴代物有三种的为: 、
、 ,
,
故答案为:4; ;
; ;
;
(3)甲苯与浓硫酸和浓硝酸的混酸加热反应生成三硝基甲苯和水发生的是取代反应,反应的化学方程式为: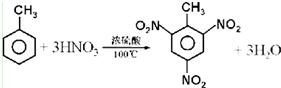 ,三甲基甲苯的系统命名法的名称为:2,4,6-三硝基甲苯,
,三甲基甲苯的系统命名法的名称为:2,4,6-三硝基甲苯,
故答案为: ;取代反应;2,4,6-三硝基甲苯;
;取代反应;2,4,6-三硝基甲苯;
(4)分子中含有1个碳碳双键,所以该有机物属于烯烃,其相对分子质量为84,根据烯烃的通式CnH2n,可以得出n=6,为己烯,分子核磁共振氢谱只有一个吸收峰,分子内所有氢原子都处于相同的化学环境,所有的氢原子是完全对称等效的,满足条件的己烯的结构简式为: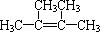 ,
,
故答案为: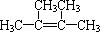 ;
;
(5)-CH2CH3为乙基,异丙基的结构简式为:-CH(CH3)2,碳碳双键的结构简式为: ,
,
故答案为:乙基;-CH(CH3)2; .
.
(6)CH3-CH(CH3)2的碳架为:C-C(C)-C,向该碳架上添加碳碳双键,只有1种方式,所以原烯烃的结构简式为:CH2=C(CH3)2,
故答案为:CH2=C(CH3)2.
B、官能团相同,组成相差CH2,属于同系物;
C、表示的是苯酚和苯甲醇,是本题类物质;不属于同系物、同分异构体;
D、官能团类型相同,数目不同,属于不同类醇,不是同系物,同分异构体;
E、官能团相同是二元酸,分子组成相差CH2,是同系物;
F、戊烯和环戊烷分子式相同,结构不同,属于同分异构体;
综上所述:属于同系物的是BE;属于同分异构体的是:AF;
故答案为:BE;AF;
(2)芳香烃的分子式是C8H10,它可能有的同分异构体为:
 、
、 、
、 、
、 ,总共有4种;
,总共有4种;苯环上的一溴取代物有3种同分异构体,说明该苯的同系物中苯环上含有3种等效H原子,
乙苯
 苯环上有3种不同氢原子,所以苯环上的一溴取代物有3种,
苯环上有3种不同氢原子,所以苯环上的一溴取代物有3种,邻二甲苯
 的苯环上有2种不同氢原子,所以苯环上的一溴取代物有2种,
的苯环上有2种不同氢原子,所以苯环上的一溴取代物有2种,对二甲苯的结构简式为:
 ,其苯环上有1种氢原子,所以苯环上的一溴取代物只有1种,
,其苯环上有1种氢原子,所以苯环上的一溴取代物只有1种,间二甲苯
 的苯环上只有3种氢原子,所以苯环上的一溴取代物有3种,
的苯环上只有3种氢原子,所以苯环上的一溴取代物有3种,所以在苯环上的一溴代物有三种的为:
 、
、 ,
,故答案为:4;
 ;
; ;
;(3)甲苯与浓硫酸和浓硝酸的混酸加热反应生成三硝基甲苯和水发生的是取代反应,反应的化学方程式为:
 ,三甲基甲苯的系统命名法的名称为:2,4,6-三硝基甲苯,
,三甲基甲苯的系统命名法的名称为:2,4,6-三硝基甲苯,故答案为:
 ;取代反应;2,4,6-三硝基甲苯;
;取代反应;2,4,6-三硝基甲苯;(4)分子中含有1个碳碳双键,所以该有机物属于烯烃,其相对分子质量为84,根据烯烃的通式CnH2n,可以得出n=6,为己烯,分子核磁共振氢谱只有一个吸收峰,分子内所有氢原子都处于相同的化学环境,所有的氢原子是完全对称等效的,满足条件的己烯的结构简式为:
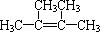 ,
,故答案为:
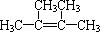 ;
;(5)-CH2CH3为乙基,异丙基的结构简式为:-CH(CH3)2,碳碳双键的结构简式为:
 ,
,故答案为:乙基;-CH(CH3)2;
 .
.(6)CH3-CH(CH3)2的碳架为:C-C(C)-C,向该碳架上添加碳碳双键,只有1种方式,所以原烯烃的结构简式为:CH2=C(CH3)2,
故答案为:CH2=C(CH3)2.
点评:本题考查了同分异构体的书写、常见有机物的命名、官能团的结构与性质、同系物与同分异构体的判断,题目难度中等,试题涉及的题量过大,知识点较多,充分考查了学生对书写知识的掌握情况.

练习册系列答案
相关题目
下列不属于取代反应的是( )
A、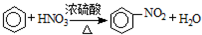 | ||
| B、CH2=CH2+Br2→BrCH2CH2Br | ||
C、CH4+Cl2
| ||
D、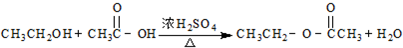 |
盛装下列溶液的试剂瓶采用的是玻璃塞的是( )
| A、Na2SiO3 |
| B、Na2CO3 |
| C、NH4Cl |
| D、HF |

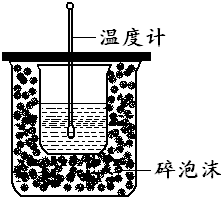 在如图所示的装置中进行中和反应的反应热测定,实验操作如下:
在如图所示的装置中进行中和反应的反应热测定,实验操作如下: