题目内容
(1)已知1,2-二溴乙烷的主要物理性质如下:
如图为实验室用乙烯与液溴作用制取1,2-二溴乙烷的部分装置图.
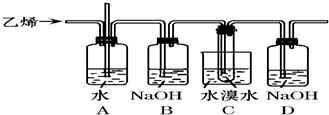
①A、C中都盛有水,C装置中水的作用分别是 .
②B和D装置都盛有NaOH溶液,D中NaOH溶液作用分别是 .
③试写出以乙醇、浓硫酸、液溴为主要原料生成1,2-二溴乙烷的主要化学反应方程式 .
(2)某化学兴趣小组选用类似制取乙炔装置用Na2C2与水反应有气体A产生,并进行有关A气体性质的探究,试回答下列问题.
①生成A的化学反应方程式为: .
②A能使溴水褪色的反应方程式为: .
| 熔点 | 沸点 | 密度 | 溶解性 |
| 9.79℃ | 131.4℃ | 2.18g/cm3 | 难溶于水,易溶于醇、醚等 |

①A、C中都盛有水,C装置中水的作用分别是
②B和D装置都盛有NaOH溶液,D中NaOH溶液作用分别是
③试写出以乙醇、浓硫酸、液溴为主要原料生成1,2-二溴乙烷的主要化学反应方程式
(2)某化学兴趣小组选用类似制取乙炔装置用Na2C2与水反应有气体A产生,并进行有关A气体性质的探究,试回答下列问题.
①生成A的化学反应方程式为:
②A能使溴水褪色的反应方程式为:
考点:溴乙烷的制取
专题:实验题
分析:(1)①该反应为制取1,2-二溴乙烷,由乙烯和溴发生加成反应生成1,2-二溴乙烷,溴易挥发,A、C中所盛都是水,其中C装置中水的作用是冷却液溴;
②溴易挥发,挥发到空气中会污染空气;
③以乙醇、浓硫酸、液溴为主要原料生成1,2-二溴乙烷,首先是乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,然后是乙烯和溴加成生成1,2-二溴乙烷,据此解答.
(2)①参照CaC2和水的反应写出Na2C2与水反应的化学方程式;
②乙炔CH≡CH能使溴水褪色是发生了加成反应.
②溴易挥发,挥发到空气中会污染空气;
③以乙醇、浓硫酸、液溴为主要原料生成1,2-二溴乙烷,首先是乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,然后是乙烯和溴加成生成1,2-二溴乙烷,据此解答.
(2)①参照CaC2和水的反应写出Na2C2与水反应的化学方程式;
②乙炔CH≡CH能使溴水褪色是发生了加成反应.
解答:
解:(1)由乙烯和溴发生加成反应生成1,2-二溴乙烷,溴易挥发,所以C装置中水的作用是冷却液溴,冷却可避免溴的大量挥发,
故答案为:冷却降温,减少溴的挥发;
(2)溴易挥发,挥发到空气中会污染空气,常温下Br2和氢氧化钠发生反应:2NaOH+Br2═NaBr+NaBrO+H2O,
故答案为:吸收逸出的溴蒸气,防止污染空气;
(3)利用乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,乙醇发生了消去反应,浓硫酸作催化剂、脱水剂,反应条件是加热到170℃,反应为:CH3CH2OH
CH2=CH2↑+H2O;乙烯分子中含有不饱和键,它和溴水发生加成反应生成无色的1,2-二溴乙烷,即CH2=CH2+Br-Br→CH2Br-CH2Br,
故答案为:CH3CH2OH
CH2=CH2↑+H2O,CH2=CH2+Br-Br→CH2Br-CH2Br;
(2)①参照CaC2和水的反应写出Na2C2与水反应的化学方程式:Na2C2+2H2O→C2H2↑+2NaOH,故答案为:Na2C2+2H2O→C2H2↑+2NaOH;
②CH≡CH能使溴水褪色是发生了加成反应,而1mol叁键能消耗2molBr2,反应为:CH≡CH+2Br2→CHBr2CHBr2,故答案为:CH≡CH+2Br2→CHBr2CHBr2.
故答案为:冷却降温,减少溴的挥发;
(2)溴易挥发,挥发到空气中会污染空气,常温下Br2和氢氧化钠发生反应:2NaOH+Br2═NaBr+NaBrO+H2O,
故答案为:吸收逸出的溴蒸气,防止污染空气;
(3)利用乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,乙醇发生了消去反应,浓硫酸作催化剂、脱水剂,反应条件是加热到170℃,反应为:CH3CH2OH
| 浓硫酸 |
| 170℃ |
故答案为:CH3CH2OH
| 浓硫酸 |
| 170℃ |
(2)①参照CaC2和水的反应写出Na2C2与水反应的化学方程式:Na2C2+2H2O→C2H2↑+2NaOH,故答案为:Na2C2+2H2O→C2H2↑+2NaOH;
②CH≡CH能使溴水褪色是发生了加成反应,而1mol叁键能消耗2molBr2,反应为:CH≡CH+2Br2→CHBr2CHBr2,故答案为:CH≡CH+2Br2→CHBr2CHBr2.
点评:本题主要考查了乙醇制备1,2-二溴乙烷,掌握相关物质的基本化学性质是解答本题的关键,平时须注意积累相关反应知识,题目不难.

练习册系列答案
相关题目
下面以橄榄岩(主要成分为硅酸镁,还有少量的Fe3+、Fe2+、Al3+及少量不溶于酸的杂质)为原料,制备硫酸镁晶体的流程图: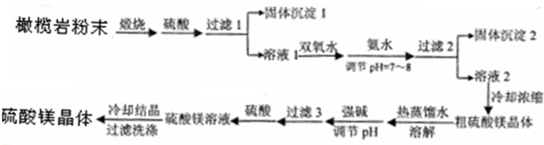
下列说法正确的是( )

下列说法正确的是( )
| A、过滤Ⅰ操作的主要目的是以硅酸盐的形式除去Si |
| B、加氨水调节pH═7-8,目的是使Fe3+、Al3+转化为氢氧化物沉淀而除去 |
| C、加双氧水时发生的主要反应为:H2O2+Fe2++2H+═Fe3++2H2O |
| D、粗硫酸镁晶体通过一系列操作后得到硫酸镁晶体,目的是使硫酸镁晶体结晶得更漂亮 |
下列反应的离子方程式书写正确的是( )
A、用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2++2OH-
| ||
| B、用二氧化硫水溶液吸收溴蒸气:SO2+Br2+2H2O=2H++SO42-+2HBr | ||
| C、在(NH4)2SO4溶液中逐滴加入少量的Ba(OH)2溶液:NH4++SO42-+Ba2++OH-=BaSO4↓+NH3?H2O | ||
| D、次氯酸钙溶液中通入少量SO2气体:Ba2++2ClO-+SO2+H2O=CaSO3↓+2HClO |


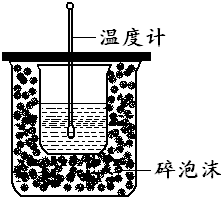 在如图所示的装置中进行中和反应的反应热测定,实验操作如下:
在如图所示的装置中进行中和反应的反应热测定,实验操作如下: