题目内容
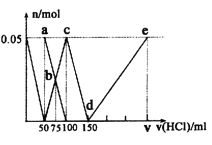
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)![]() 2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是
2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是
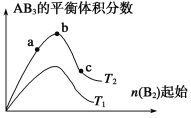
A. a、b、c三个状态只有b是平衡状态
B. 达到平衡时A2的转化率大小为:b>a>c
C. 若T2<T1,则正反应一定是吸热反应
D. b点时,平衡体系中A、B原子数之比接近1∶3
【答案】D
【解析】
A.图像揭示了T2温度下可逆反应A2(g)+3B2(g)![]() 2AB3(g),改变B的初始物质的量,分别达到平衡状态时生成物AB3的体积分数的变化曲线,所以曲线上的点对应的状态都是平衡状态。A项错误;
2AB3(g),改变B的初始物质的量,分别达到平衡状态时生成物AB3的体积分数的变化曲线,所以曲线上的点对应的状态都是平衡状态。A项错误;
B.由图像可知a→b→c过程中B2的初始物质的量逐渐增大,根据勒夏特列原理,平衡向正反应方向移动,因A2的初始量不变,所以A2的转化率逐渐增大,即a<b<c,B项错误;
C.由图像可知,当B2的初始物质的量相同时,当T2→T1时平衡状态的AB3的体积分数减小,说明平衡向逆反应方向移动。因T2<T1即T2→T1是升高温度,根据勒夏特列原理,升高温度平衡向吸热反应方向移动,所以该反应的逆反应是吸热反应,则正反应为放热反应,C项错误;
D.分析图像知,T2温度下,b点前随着B2的物质的量增加,AB3的体积分数增大,说明因平衡移动增加的AB3的分子数超过容器中气体分子总数的增加;b点后随着B2的物质的量增加,AB3的体积分数减小,说明因平衡移动增加的AB3的分子数小于容器中气体分子总数的增加;参加反应的物质的量之比等于其化学计量数之比时生成物的平衡体积分数最大,所以b点时,A2和B2初始物质的量之比接近1:3,根据原子守恒,即平衡体系中A、B原子数之比接近1∶3,D项正确;答案选D。

 优学名师名题系列答案
优学名师名题系列答案【题目】某研究小组为探究SO2和Fe(NO3)3溶液的反应的实质。设计了如下图所示装置进行实验.
已知:1.0 mol/L的Fe(NO3)3溶液的pH=1。

请回答:
(1)装置A中用于添加浓硫酸的仪器名称为__________________。
(2)实验前鼓入N2的目的是________________________________。
(3)装置B中产生了白色沉淀,其成分是________,说明SO2具有________性。
(4)分析B中产生白色沉淀的原因。
观点1:SO2与Fe3+反应;
观点2:在酸性条件下SO2与NO3-反应;
①若观点1正确,除产生沉淀外,还应观察到的现象是_________________。
②按观点2,装置B中反应的离子方程式是______________________________,
③有人认为,如将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验,也可验证观点2是否正确。此时应选择的最佳试剂是(填序号)_____。
A.1 mol/L稀硝酸 |
B.1.5 mol/L Fe(NO3)2溶液 |
C.6.0 mol/L NaNO3溶液和0.2 mol/L盐酸等体积混合的溶液 |
D.3.0 mol/L NaNO3溶液和0.1mol/L硫酸等体积混合的溶液 |
【题目】下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(1)原子半径最小的元素是____(填元素名称),写出⑧的原子结构示意图______。
(2)最高价氧化物对应的水化物中,碱性最强的是___(用化学式回答,下同),酸性最强的是___。
(3)①与⑤形成的化合物中,化学键类型为_____。
(4)⑦与⑨形成的化合物的电子式为___,②与④形成的原子个数比为1:2的化合物的结构式为____。
(5)③、④、⑥的原子半径由大到小的顺序为_____(用元素符号回答)。
(6)为探究元素②和⑧的非金属性强弱,某同学设计了如图所示的装置进行实验(夹持仪器已略去,装置气密性良好)。请回答:
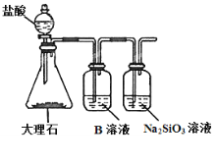
a.溶液B的作用是_______
b.若看到____现象,即可证明酸性_______(用化学式回答),则非金属性_______(用元素符号回答)。
c.上述实验中,能说明②和⑧非金属性强弱的化学方程式是_____________。