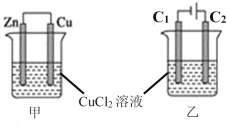
��Ŀ����
����Ŀ����NA��������٤��������ֵ������������ȷ����
A. ��Ǧ���ص���Ȼ�����Һ�õ���״����22.4L����ʱ������Ǧ������������������ĿΪ4NA
B. 1L0.1mol��L��1NH4Cl��Һ�к��еĵ�ԭ����С��0.1NA
C. 3.0g�������Ǻͱ�������ɵĻ�����к��е�ԭ������Ϊ0.3NA
D. ������������Ӧ���ɱ�״����22.4L�Ȼ��⣬���ѻ�ѧ��������Ϊ2NA
���𰸡�A
��������
A����Ǧ���ص���Ȼ�����Һ�õ�22.4L H2���������ת�Ƶ��ӵ����ʵ���Ϊ2mol��Ǧ���ص������缫��ӦʽΪPbO2+2e-+4H+=Pb2++2H2O����֪����4mol�������ӣ�����������Ǧ�����к������Ӹ���Ϊ4NA����A��ȷ��
B. 1L0.1mol��L��1NH4Cl��Һ�к��еĵ�ԭ�ӵ����ʵ���Ϊ1L��0.1molL-1=0.1mol�����Ե�ԭ��������0.1NA����B����
C�������Ǻͱ��������ʽ��ΪCH2O����3.0gCH2O��ԭ����=![]() ��4��NA=0.4NA����C����
��4��NA=0.4NA����C����
D������Ӧ����2molHClʱ������2mol��ѧ�����ʵ����ɱ����22.4LHCl����1molHClʱ������1mol��ѧ������NA������D����
��ѡA��

 �¿α�ͬ��ѵ��ϵ�д�
�¿α�ͬ��ѵ��ϵ�д�����Ŀ��ij�о�С��Ϊ̽��SO2��Fe(NO3)3��Һ�ķ�Ӧ��ʵ�ʡ����������ͼ��ʾװ�ý���ʵ��.
��֪��1.0 mol/L��Fe(NO3)3��Һ��pH��1��

��ش�
��1��װ��A����������Ũ�������������Ϊ__________________��
��2��ʵ��ǰ����N2��Ŀ����________________________________��
��3��װ��B�в����˰�ɫ��������ɷ���________��˵��SO2����________�ԡ�
��4������B�в�����ɫ������ԭ��
�۵�1��SO2��Fe3����Ӧ��
�۵�2��������������SO2��NO3-��Ӧ��
�����۵�1��ȷ�������������⣬��Ӧ�۲쵽��������_________________��
�ڰ��۵�2��װ��B�з�Ӧ�����ӷ���ʽ��______________________________��
��������Ϊ���罫װ��B�е�Fe(NO3)3��Һ�滻Ϊ�������������Һ������ͬ�����½���ʵ�飬Ҳ����֤�۵�2�Ƿ���ȷ����ʱӦѡ�������Լ���(�����)_____��
A��1 mol/Lϡ���� |
B��1.5 mol/L Fe(NO3)2��Һ |
C��6.0 mol/L NaNO3��Һ��0.2 mol/L����������ϵ���Һ |
D��3.0 mol/L NaNO3��Һ��0.1mol/L����������ϵ���Һ |