题目内容
【题目】(1)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H)。
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/kJ·mol—1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
①比较下列两组物质的熔点高低(填“>”或“<”=)
SiC_____________Si;SiCl4_____________SiO2
②工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g)该反应的反应热△H=_____________kJ/mol.
Si(s)+4HCl(g)该反应的反应热△H=_____________kJ/mol.
(2)已知化合物Na2O的晶胞如图。
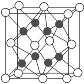
①其中O2-离子的配位数为________,
②该化合物与MgO相比,熔点较高的是________。(填化学式)
③已知该化合物的晶胞边长为apm,则该化合物的密度为___g·cm-3(只要求列出算式,不必计算出数值,阿伏加德罗常数的数值为NA)。
【答案】> < +236kJ/mol 8 MgO 4×62/a3×10-30NA
【解析】
(1)①SiC和Si均为原子晶体,所以比较这两种物质的熔点大小,可以通过键能大小判断,由于Si-C键能更大,所以SiC熔点更高;四氯化碳是分子晶体而SiO2是原子晶体,一般原子晶体的熔点远高于分子晶体的熔点,所以SiO2熔点更高;
②由键能计算反应焓变,公式为:ΔH=反应物总键能-生成物总键能;其次要注意,1mol硅单质中,Si-Si键一共有2mol,所以该反应的焓变为:![]() ;
;
(2)①由Na2O的化学式和晶胞结构可知,晶胞中黑球表示Na+,位于晶胞内部,白球表示O2-,位于顶点和面心处;所以O2-的配位数为8;
②MgO是由带电量更高的Mg2+与O2-形成的,因此MgO的熔点比Na2O高;
③化合物晶体的密度=构成晶体的晶胞的密度,所以: 。
。

【题目】碳酸锰是制造电信器材软磁铁氧体、合成二氧化锰和制造其它锰盐的原料,用于医药、电焊条辅助原料等。工业上用氯化铵焙烧菱锰矿粉制备高纯度碳酸锰的工艺流程如下:
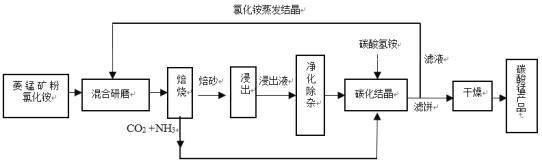
已知:①菱锰矿粉的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属Mn+离子浓度c(Mn+)=0.1 mol L -1,形成M(OH)n沉淀的pH范围如下:
金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Mg2+ |
开始沉淀的pH | 6.3 | 1.5 | 3.8 | 8.8 | 9.6 |
沉淀完全的pH | 8.3 | 2.8 | 5.2 | 10.8 | 11.6 |
③常温下,Ksp(CaF2) =1.46×10-10,Ksp(MgF2) = 7.30×10-11
回答下列问题:
(1)混合研磨成细粉的目的是_________________。
(2)“焙烧”时发生的主要反应的化学方程式为_____________。
(3)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为________;再调节溶液pH范围为________将Al3+、Fe3+变为沉淀除去;再加入NH4F沉淀Ca2+、Mg2+,当c(Ca2+)=1.0×10-5molL-1时,c(Mg2+)=______molL-1。
(4)碳化结晶过程中不能用(NH4)2CO3溶液代替NH4HCO3溶液可能的原因是_________。
(5)在操作流程中可以循环利用的物质是__________。
(6)测定碳酸锰产品的纯度。
称取0.2500g碳酸锰产品于锥形瓶中,加25.00 mL磷酸,加热,碳酸锰全部转化为[Mn(PO4)2]3-,冷却至室温。加水稀释至50 mL,滴加2~3滴指示剂,然后用浓度为0.2000 mol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定(反应为:[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2![]() )。重复操作3次,记录数据如下表:
)。重复操作3次,记录数据如下表:
滴定 次数 | 0.2000mol·L-1的硫酸亚铁铵标准溶液读数(mL) | |
滴定前 | 滴定后 | |
1 | 0.10 | 10.20 |
2 | 0.22 | 11.32 |
3 | 1.05 | 10.95 |
则产品的纯度=____________,若滴定终点时俯视读数,则测得的碳酸锰粗产品的纯度__________。(填“偏高”、“偏低”或“无影响”)。