题目内容
【题目】N、O、Si、S、Al、Fe、Cu是常见的七种元素.
(1)Si位于元素周期表第周期第族.
(2)Cu原子的价层电子排布图为 .
(3)基态Fe原子有个未成对电子,Fe3+的电子排布式为 . 可用硫氰化钾检验Fe3+ , 形成的配合物的颜色为 .
(4)用“>”或“<”填空:
离子半径 | 电负性 | 熔点 | 酸性 |
O2﹣ Na+ | FO | 金刚石 晶体硅 | H2SO4HClO4 |
(5)氢元素和上述非元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为;分子中既含有极性共价键、又含有非极性共价键的化合物是(填化学式,任写一种).
(6)O和Cu形成的一种离子化合物的晶体结构如图,则铜离子的电荷为 . 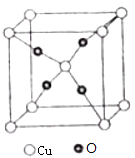
【答案】
(1)三,IVA
(2)![]()
(3)4,1s22s22p63s23p63d5,血红色
(4)>,>,>,<
(5)sp3,H2O2 或N2H4
(6)+1
【解析】解:(1)Si元素原子核外有3个电子层,最外层电子数为4,处于周期表中第三周期IVA族,
所以答案是:三、IVA;
(2)Cu原子价层电子排布式为3d104s1,价层电子排布图为: ![]() ,
,
所以答案是: ![]() ;
;
(3)Fe原子核外电子排布式为1s22s22p63s23p63d64s2,基态Fe原子3d轨道有4个未成对电子,失去4s能级2个电子及3d能级1个电子形成Fe3+,Fe3+的电子排布式为1s22s22p63s23p63d5,可用硫氰化钾检验Fe3+,形成的配合物的颜色为血红色,
所以答案是:4;1s22s22p63s23p63d5;血红色;
(4)电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:O2﹣>Na+;
同周期自左而右,元素电负性增大,故电负性F>O;
金刚石与晶体硅均属于原子晶体,C原子半径较小,键长更短,故C﹣C键更稳定,熔沸点金刚石>晶体硅;
非金属性S<Cl,非金属性越强,最高价含氧酸的酸性越强,故酸性:H2SO4<HClO4,
所以答案是:>;>;>;<;
(5)氢元素和上述非元素形成的二元共价化合物中,分子呈三角锥形为NH3,分子中N原子形成3个N﹣H键,含有1对孤电子对,故N原子采取sp3杂化,分子中既含有极性共价键、又含有非极性共价键的化合物是H2O2 或N2H4,
所以答案是:sp3; H2O2 或N2H4;
(6)铜离子个数=1+8× ![]() =2,氧离子个数=4,所以该化合物为Cu2O,则铜离子的电荷为+1,
=2,氧离子个数=4,所以该化合物为Cu2O,则铜离子的电荷为+1,
所以答案是:+1.

 名校课堂系列答案
名校课堂系列答案【题目】中国传统文化对人类文明贡献巨大,古代文献中充分记载了古代化学研究成果。下列关于KNO3的古代文献,对其说明不合理的是
目的 | 古代文献 | 说明 | |
A | 性质 | “…凡研消(KNO3)不以铁碾入石臼,相激火生,祸不可测”一《天工开物》 | KNO3能自燃 |
B | 鉴别 | 区分硝石(KNO3)和朴消(Na2SO4):“以火烧之,紫青烟起,乃真硝石也” ——《本草经集注》 | 利用焰色反应 |
C | 提纯 | “…(KNO3)所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”——《开宝本草》 | 溶解、蒸发、结晶 |
D | 使用 | “(火药)乃焰消(KNO3)、硫磺、山木炭所合,以为烽燧铜诸药者"——《本草纲目》 | 利用KNO3的氧化性 |
A. A B. B C. C D. D