题目内容
【题目】常温下,下列物质的溶液pH>7的是
A.K2SO4B.NH4ClC.Na2CO3D.Cu(NO3)2
【答案】C
【解析】
常温下,溶液的pH>7,说明该溶液呈碱性,溶液中的溶质可能是碱或强碱弱酸盐,
A.K2SO4是强碱强酸盐,其溶液呈中性,A项错误;
B.NH4Cl是强酸弱碱盐,铵根离子水解导致溶液呈酸性,溶液的pH<7,B项错误;
C.Na2CO3是强碱弱酸盐,碳酸根离子水解导致溶液呈碱性,溶液的pH>7,C项正确;
D.Cu(NO3)2是强酸弱碱盐,铜离子水解导致溶液呈酸性,溶液的pH<7,D项错误;
答案选C。

【题目】N、O、Si、S、Al、Fe、Cu是常见的七种元素.
(1)Si位于元素周期表第周期第族.
(2)Cu原子的价层电子排布图为 .
(3)基态Fe原子有个未成对电子,Fe3+的电子排布式为 . 可用硫氰化钾检验Fe3+ , 形成的配合物的颜色为 .
(4)用“>”或“<”填空:
离子半径 | 电负性 | 熔点 | 酸性 |
O2﹣ Na+ | FO | 金刚石 晶体硅 | H2SO4HClO4 |
(5)氢元素和上述非元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为;分子中既含有极性共价键、又含有非极性共价键的化合物是(填化学式,任写一种).
(6)O和Cu形成的一种离子化合物的晶体结构如图,则铜离子的电荷为 . 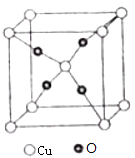
【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境,实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4·5H2O)及副产物ZnO,制备流程图如下:

已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH熔液生成[Zn(OH)4]2-下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol/L计算)。
Fe3+ | Fe2+ | Zn2+ | |
开始沉淀的pH | 1.1 | 5.8 | 5.9 |
沉淀完全的pH | 3.0 | 8.8 | 8.9 |
请回答下列问题:
(1)滤液A中加入H2O2反应的离子方程式为__________________________________。
(2)加入ZnO调节pH=a的目的是___________________,a的范围是______________。
(3)下列试剂可作为Y试剂的是______________。
A.ZnO B.NaOH C.Na2CO3 D.ZnSO4
(4)若在滤液C中逐滴加入盐酸直到过量,则产生的现象是____________________。
(5)由不溶物E生成溶液D的化学方程式为____________________________________。
(6)由溶液D制胆矾晶体包含的主要操作步骤是,蒸发浓缩、________、____________。
