��Ŀ����
����Ŀ��ij�о�С��Ϊ��̽�������������Ӧ�����������˼���ʵ�顣
����д���пհף�
[ʵ��һ]����ͼ��ʾװ�ã��ռ�һ�Թܼ���������Ļ�����壬���պ�۲쵽����Ͳ���γ�һ��ˮ������Ϊ���Ȼ������ɡ�
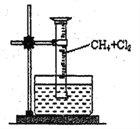
(1)�÷�Ӧ�ķ�Ӧ����Ϊ_____________________��
(2)�÷�Ӧ�Ļ�ѧ����ʽΪ(ֻд��һ��)______________��
(3)ˮ����ʢ�ŵ�Һ��ӦΪ_______��(����)
A.ˮ B.����ʯ��ˮ C.����ʳ��ˮ D.����NaHCO3��Һ
(4)��ʵ���ʵ������Ϊ��____________��_____________���Թܱ��ϳ�����״Һ��
(5)����״Һ���к��е��л����ﹲ��_______�֡�
[ʵ���]�ռ�һ�Թܼ���������Ļ�����壬���շ�Ӧ�μ�AgNO3��Һ�������а�ɫ�������ɣ���Ϊ���Ȼ������ɡ�
(6)����Ϊ��ʵ����Ƶó��Ľ����Ƿ���ȷ��______��������ȷ�������ǣ�_________________��
[ʵ����]����һ:�ռ����Թ�����������10mL����ˮ�����������DISϵͳ��pH����������Һ��pH(��ͬ)�����pH=3.26
�����:�ռ�һ�Թܼ����������Ļ������(��ռ50%)����40W���չ���¹���6min����l0mL����ˮ����������pH=1.00��
(7)�жϸ÷�Ӧ�����Ȼ������ɵ�������__________________________________��
���𰸡� ȡ����Ӧ CH4+Cl2![]() CH3Cl+HCl C ��Ͳ��Һ������ ����ɫ��ȥ 3 ����ȷ ��ˮ�м���AgNO3��ҺҲ�������ɫ���� �������õ�pHֵ�Ȳ���һ��õ�pHֵ��
CH3Cl+HCl C ��Ͳ��Һ������ ����ɫ��ȥ 3 ����ȷ ��ˮ�м���AgNO3��ҺҲ�������ɫ���� �������õ�pHֵ�Ȳ���һ��õ�pHֵ��
������������ʵ�鷽����������ۣ���1����������������ȡ����Ӧ����2���������������ȡ����Ӧ������ѧ��Ӧ����ʽΪCH4��Cl2![]() CH3Cl��HCl����3��A�������������ˮ������������������Ӧ����˲���ʢ��H2O����A����B�������뱥��ʯ��ˮ������Ӧ��ˮ���в���ʢ�ű���ʯ��ˮ����B����C������ʳ��ˮ���������ĵ��ܽ�ȣ��ұ���ʳ��ˮ���������ɵ�HCl�������Ͳ������ѹǿ��С����Ͳ�е�Һ����������C��ȷ��D������HCl����NaHCO3������Ӧ����CO2����Ͳ�е�Һ�治����������D����4������������������Ӧ������ɫ������ȥ����ΪCH2Cl2��CHCl3��CCl4ΪҺ�壬��HCl���ڱ���ʳ��ˮ�������Ͳ��ѹǿ��С������Ͳ��Һ������������ʳ��ˮ���о�����������Ͳ�ڱ�����״Һ������5������ΪCH3Cl��CH2Cl2��CHCl3��CCl4������CH3ClΪ��̬����������ΪҺ̬�������״Һ���к��е��л���CH2Cl2��CHCl3��CCl4������3�֣���6����������ˮ����Һ�д���Cl��������AgNO3��Һ��Ҳ�ܲ�����ɫ��������˸�ʵ��ó����۲���ȷ����7������ʵ�飬��������pHС�ڲ���I��ĵ�pH��˵��c(H��)����������HCl��
CH3Cl��HCl����3��A�������������ˮ������������������Ӧ����˲���ʢ��H2O����A����B�������뱥��ʯ��ˮ������Ӧ��ˮ���в���ʢ�ű���ʯ��ˮ����B����C������ʳ��ˮ���������ĵ��ܽ�ȣ��ұ���ʳ��ˮ���������ɵ�HCl�������Ͳ������ѹǿ��С����Ͳ�е�Һ����������C��ȷ��D������HCl����NaHCO3������Ӧ����CO2����Ͳ�е�Һ�治����������D����4������������������Ӧ������ɫ������ȥ����ΪCH2Cl2��CHCl3��CCl4ΪҺ�壬��HCl���ڱ���ʳ��ˮ�������Ͳ��ѹǿ��С������Ͳ��Һ������������ʳ��ˮ���о�����������Ͳ�ڱ�����״Һ������5������ΪCH3Cl��CH2Cl2��CHCl3��CCl4������CH3ClΪ��̬����������ΪҺ̬�������״Һ���к��е��л���CH2Cl2��CHCl3��CCl4������3�֣���6����������ˮ����Һ�д���Cl��������AgNO3��Һ��Ҳ�ܲ�����ɫ��������˸�ʵ��ó����۲���ȷ����7������ʵ�飬��������pHС�ڲ���I��ĵ�pH��˵��c(H��)����������HCl��

����Ŀ��N��O��Si��S��Al��Fe��Cu�dz���������Ԫ�أ�
��1��Siλ��Ԫ�����ڱ������ڵ��壮
��2��Cuԭ�ӵļ۲�����Ų�ͼΪ ��
��3����̬Feԭ������δ�ɶԵ��ӣ�Fe3+�ĵ����Ų�ʽΪ �� �������軯�ؼ���Fe3+ �� �γɵ���������ɫΪ ��
��4���á�����������գ�
���Ӱ뾶 | �縺�� | �۵� | ���� |
O2�� Na+ | FO | ���ʯ ����� | H2SO4HClO4 |
��5����Ԫ�غ�������Ԫ���γɵĶ�Ԫ���ۻ������У����ӳ������Σ��÷��ӵ�����ԭ�ӵ��ӻ���ʽΪ�������мȺ��м��Թ��ۼ����ֺ��зǼ��Թ��ۼ��Ļ����������ѧʽ����дһ�֣���
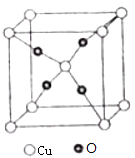
��6��O��Cu�γɵ�һ�����ӻ�����ľ���ṹ��ͼ����ͭ���ӵĵ��Ϊ ��