题目内容
【题目】实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
(1)容量瓶不能用于(填序号).
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.用来加热溶解固体溶质
(2)根据计算用托盘天平称取NaOH的质量为g.在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度0.1mol/L(填“大于”“等于”或“小于”,下同).若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度0.1mol/L.
(3)根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为mL(计算结果保留一位小数)配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是 . 在配制过程中,下列操作中,能引起误差偏高的有(填代号).
①未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
②定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
③定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
④定容时,俯视刻度线.
【答案】
(1)B,C,D
(2)2.0,小于,小于
(3)13.6,将浓硫酸沿器壁缓缓倒入水中,并用玻璃棒不断搅拌,①④
【解析】解:(1)容量瓶瓶为配制特定体积的一定物质的量浓度溶液的专用仪器,只有刻度线,没有刻度,所以不能用来量取容量瓶规格以下的任意体积的液体,容量瓶为精密仪器,不能用来溶解固体,不能长时间储存溶液,
故选:BCD;
(2)需要0.1mol/LNaOH溶液450mL,应选择500mL容量瓶,实际配制500mL溶液,需要溶质氢氧化钠的质量m=0.1mol/L×0.5L×40g/mol=2.0g;
定容时仰视刻度线,导致溶液体积偏大,溶液浓度偏小;若NaOH溶液在转移至容量瓶时,洒落了少许,导致溶质的物质的量偏小,溶液浓度偏小;
所以答案是:2.0; 小于;小于;
(3)质量分数为98%、密度为1.84g/cm3的浓硫酸的物质的量浓度C= ![]() =18.4mol/L,设需要浓硫酸体积为V,则依据溶液稀释规则:V×18.4mol/L=0.5mol/L×0.5L,解得V=13.6mL;
=18.4mol/L,设需要浓硫酸体积为V,则依据溶液稀释规则:V×18.4mol/L=0.5mol/L×0.5L,解得V=13.6mL;
浓硫酸稀释的正确操作方法:将浓硫酸沿器壁缓缓倒入水中,并用玻璃棒不断搅拌;
①未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中,冷却后,溶液体积偏小,溶液浓度偏高,故选;
②定容时,加蒸馏水超过刻度线,又用胶头滴管吸出,导致溶质的物质的量偏小,溶液浓度偏小,故不选;
③定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线,导致溶液体积偏大,溶液浓度偏小,故不选;
④定容时,俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故选;
所以答案是:13.6mL;将浓硫酸沿器壁缓缓倒入水中,并用玻璃棒不断搅拌; ①④.

【题目】N、O、Si、S、Al、Fe、Cu是常见的七种元素.
(1)Si位于元素周期表第周期第族.
(2)Cu原子的价层电子排布图为 .
(3)基态Fe原子有个未成对电子,Fe3+的电子排布式为 . 可用硫氰化钾检验Fe3+ , 形成的配合物的颜色为 .
(4)用“>”或“<”填空:
离子半径 | 电负性 | 熔点 | 酸性 |
O2﹣ Na+ | FO | 金刚石 晶体硅 | H2SO4HClO4 |
(5)氢元素和上述非元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为;分子中既含有极性共价键、又含有非极性共价键的化合物是(填化学式,任写一种).
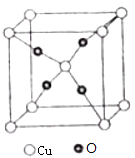
(6)O和Cu形成的一种离子化合物的晶体结构如图,则铜离子的电荷为 .