题目内容
【题目】研究化学反应时,既要考虑物质变化与能量变化,也要关注反应的快慢与限度。回答下列问题:
I.现有反应:①CaCO3=CaO+CO2↑,②Fe +H2SO4=FeSO4+ H2↑。
(1)两反应中属于吸热反应的是____(填序号)。
(2)Fe-Cu 原电池的装置如图所示。
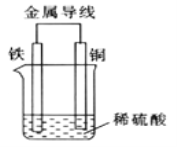
①溶液中H+向______(填“铁”或“铜” )电极方向移动。
②正极的现象是_______,负极的电极反应式为_________。
II.某可逆反应:2A(g)![]() B(g)+D(g)在3 种不同条件下进行,B和D的起始浓度均为0,反应物A 的浓度随反应时间的变化情况如下表:
B(g)+D(g)在3 种不同条件下进行,B和D的起始浓度均为0,反应物A 的浓度随反应时间的变化情况如下表:
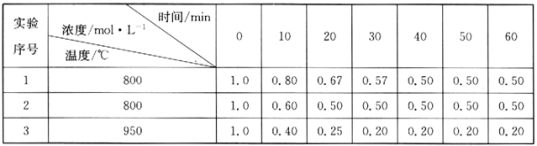 (3)实验1中,在10~20 min内,以物质A表示的平均反应速率为_______mol/(L·min) ,50min时,v(正)______(填“<”“>”或“=”)v(逆)。
(3)实验1中,在10~20 min内,以物质A表示的平均反应速率为_______mol/(L·min) ,50min时,v(正)______(填“<”“>”或“=”)v(逆)。
(4)0~20min内,实验2 比实验1的反应速率______ (填“快”或“慢”),其原因可能是_______。
(5)实验3 比实验1的反应速率快,其原因是_________。
【答案】 ① 铜 有气泡产生 Fe-2e-=Fe2+ 0.013 = 快 实验2中使用了催化剂 实验3中反应温度更高
【解析】(1)碳酸钙分解是吸热反应,铁与稀硫酸发生的置换反应是放热反应;(2)①铁的金属性强于铜,铁负极,铜是正极,正极发生得到电子的还原反应,因此溶液中H+向正极即向铜电极方向移动。②正极上氢离子得到电子生成氢气,则正极的现象是有气泡产生,负极发生铁失去电子的氧化反应,电极反应式为Fe-2e-=Fe2+。(3)实验1中,在10~20min内,A物质的浓度减少了0.80mol/L-0.67mol/L=0.13mol/L,则以物质A表示的平均反应速率为0.13mol/L÷10min=0.013mol/(L·min),50min时反应物浓度不再发生变化,反应达到平衡状态,则v(正)=v(逆)。(4)根据表中数据可知0~20min内,实验2中A的浓度变化量大于实验1中A的浓度变化量,因此实验2中的反应速率快,由于最终平衡时A的浓度仍然相等,即没有改变平衡状态,所以其原因可能是实验2中使用了催化剂。(5)由于实验3中反应温度更高,所以实验3比实验1的反应速率快。

【题目】N、O、Si、S、Al、Fe、Cu是常见的七种元素.
(1)Si位于元素周期表第周期第族.
(2)Cu原子的价层电子排布图为 .
(3)基态Fe原子有个未成对电子,Fe3+的电子排布式为 . 可用硫氰化钾检验Fe3+ , 形成的配合物的颜色为 .
(4)用“>”或“<”填空:
离子半径 | 电负性 | 熔点 | 酸性 |
O2﹣ Na+ | FO | 金刚石 晶体硅 | H2SO4HClO4 |
(5)氢元素和上述非元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为;分子中既含有极性共价键、又含有非极性共价键的化合物是(填化学式,任写一种).
(6)O和Cu形成的一种离子化合物的晶体结构如图,则铜离子的电荷为 . 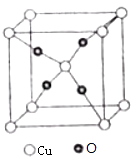
【题目】已知:CO(g)+2H2(g)CH3OH(g)△H=﹣a kJmol﹣1 . ①经测定不同温度下该反应的平衡常数如下:
温度(℃) | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)=0.4molL﹣1、c(H2)=0.4molL﹣1、c(CH3OH)=0.8molL﹣1 , 则此时v正v逆(填“>”、“<”或“=”).
②某温度下,在体积固定的2L的密闭容器中将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如下:
时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
则0~15min,用H2表示的平均反应速率为 , 达到平衡时CO的转化率为 .