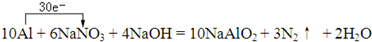题目内容
5.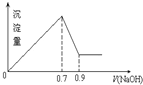 现有AlCl3和Fe2(SO4)3的混合溶液,向其中不断加入 NaOH溶液得到的沉淀的量与加入NaOH溶液的体积的关系如图所示,则原溶液中SO42-与Cl-的物质的量浓度之比为( )
现有AlCl3和Fe2(SO4)3的混合溶液,向其中不断加入 NaOH溶液得到的沉淀的量与加入NaOH溶液的体积的关系如图所示,则原溶液中SO42-与Cl-的物质的量浓度之比为( )| A. | 3:1 | B. | 1:12 | C. | 3:2 | D. | 6:1 |
分析 由图可知加入0.7molNaOH,沉淀达最大量,沉淀为Fe(OH)3、Al(OH)3,根据氢氧根守恒可知3n[Fe(OH)3]+3n[Al(OH)3]=n(OH-)=0.7mol,加入0.9molNaOH时,沉淀由最大值减小为最小值,故0.2molNaOH溶解氢氧化铝沉淀,根据反应Al(OH)3+NaOH=NaAlO2+2H2O可知,n[Al(OH)3]=0.2mol,计算出n[Fe(OH)3],进而原溶液中SO42-与Cl-的物质的量浓度.
解答 解:由图可知加入0.7molNaOH,沉淀达最大量,沉淀为Fe(OH)3、Al(OH)3,根据氢氧根守恒可知3n[Fe(OH)3]+3n[Al(OH)3]=n(OH-)=0.7mol,加入0.9molNaOH时,沉淀由最大值减小为最小值,故0.2molNaOH溶解氢氧化铝沉淀,根据反应Al(OH)3+NaOH=NaAlO2+2H2O可知,n[Al(OH)3]=0.2mol,
所以n[Fe(OH)3]=$\frac{0.7mol-0.2mol×3}{3}$=$\frac{1}{30}$mol,
原溶液中n(Cl-)=3n[Al(OH)3]=0.6mol,原溶液中n(SO42-)=$\frac{3}{2}$n[Fe(OH)3]=$\frac{3}{2}$×$\frac{1}{30}$mol=0.05mol,所以原溶液中SO42-、Cl-的物质的量之比为0.05mol:0.6mol=1:12.
故选:B.
点评 本题考查有关混合物反应的计算,题目难度中等,注意氢氧化铝能和强碱反应是解题的关键所在,试题考查了学生的分析、理解能力及化学计算能力.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
15.设NA表示阿伏加德罗常数,下列说法中不正确的是( )
| A. | 53g Na2C03固体中含有的离子数总数为1.5NA | |
| B. | 78 g Na2O2与足量的水充分反应,转移的电子数目为NA | |
| C. | 46 g NO2 和 N2O4混合气体中含有原子数为3NA | |
| D. | 在标准状况下,22.4 L SO3中含原子数为4 NA |
16.如表为元素周期表的一部分,參照元素①-⑤在表中的位置,下列判断正确的是( )
| 族 周期 | IA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ① | |||||||
| 3 | ② | ③ | ④ | ⑤ | ||||
| A. | 金属性③>② | B. | ④原子核外有4个电子层 | ||
| C. | 原子半径⑤>③ | D. | 元素①④最高化合价相等 |
13.对于数以千万计的化学物质和为数更多的化学反应,分类的作用几乎是无可替代的.下列物质分类的正确组合是( )
| 混合物 | 化合物 | 单质 | 盐 | |
| A | 盐酸溶液 | NaOH溶液 | 石墨 | 食盐 |
| B | 水玻璃 | KNO3晶体 | O3 | 纯碱 |
| C | 氢氧化铁胶体 | 澄清石灰水 | 铁 | 石灰石 |
| D | CuSO4•5H2O | CaCl2 | 水银 | CaO |
| A. | A | B. | B | C. | C | D. | D |
20.化学概念之间可能存在如图所示的从属关系:下列有关概念相互关系的说法中正确的是( )


| A. | 化合物与单质属于包含关系 | |
| B. | 化合物与电解质属于交叉关系 | |
| C. | 分散系与胶体属于包含关系 | |
| D. | 氧化还原反应与化合反应属于并列关系 |
10.下列金属冶炼原理对应的冶炼方法,与工业上冶炼铝相同的是( )
| A. | 2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl↑ | B. | Fe+CuSO4═FeSO4+Cu | ||
| C. | Fe203+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | D. | 2Ag2O$\frac{\underline{\;\;△\;\;}}{\;}$4Ag+O2↑ |
17.下列有关物质性质用途叙述正确的是( )
①84消毒液和洁厕灵都显酸性
②Na2CO3、NaHCO3溶液都呈碱性
③配制FeCl3溶液时加入少量的盐酸
④天然气和氢气都是可再生的能源.
①84消毒液和洁厕灵都显酸性
②Na2CO3、NaHCO3溶液都呈碱性
③配制FeCl3溶液时加入少量的盐酸
④天然气和氢气都是可再生的能源.
| A. | ①② | B. | ②③ | C. | ②④ | D. | ③④ |
14.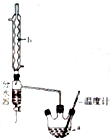 实验室通常以乙醇、乙酸和浓硫酸混合加热制备乙酸乙酯,装置如图所示
实验室通常以乙醇、乙酸和浓硫酸混合加热制备乙酸乙酯,装置如图所示
(1)请用同位素示踪法表示乙酸和乙醇发生酯化反应的反应原理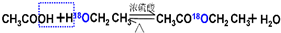
(2)装置中,b的名称为球形冷凝管(冷凝管),其主要作用是冷凝回流;加热前,通常需要在a中加入碎瓷片,目的是防止暴沸
(3)为了证明浓硫酸的作用,某同学进行了以下4个实验,实验开始先用酒精灯微热3min,再加热使之微微沸腾3min,实验结束后测分水器中有机物的厚度,实验记录如表:
①为更好地测定酯层厚度,可预先向饱和Na2CO3溶液中滴加1滴酚酞试液,每次实验结束后可观察到分水器中的现象是液体分层,上层呈无色,下层呈红色
②分析实验A、B、C的数据,可以得出浓硫酸在反应中的作用是催化剂、吸水剂;实验D和实验C对照,你又能得出的结论是对该反应起催化作用的实际上为H+
(4)本实验制备乙酸乙酯的装置与教材装置相比较突出的优点是一是增加了温度计,有利于控制发生装置中反应液的温度,二是增加了冷凝装置,有利于收集产物,三是增加了分水器,能够在反应进行时很容易的把水分离出来,从而使平衡正向移动,提高乙酸乙酯的产率(至少答出两点)
 实验室通常以乙醇、乙酸和浓硫酸混合加热制备乙酸乙酯,装置如图所示
实验室通常以乙醇、乙酸和浓硫酸混合加热制备乙酸乙酯,装置如图所示(1)请用同位素示踪法表示乙酸和乙醇发生酯化反应的反应原理
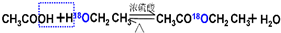
(2)装置中,b的名称为球形冷凝管(冷凝管),其主要作用是冷凝回流;加热前,通常需要在a中加入碎瓷片,目的是防止暴沸
(3)为了证明浓硫酸的作用,某同学进行了以下4个实验,实验开始先用酒精灯微热3min,再加热使之微微沸腾3min,实验结束后测分水器中有机物的厚度,实验记录如表:
| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 有机层厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL 18mol•L-1浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 饱和Na2CO3溶液 | 0.1 |
| C | 3mL乙醇、2mL乙酸、6mL 3mol•L-1硫酸 | 饱和Na2CO3溶液 | 1.2 |
| D | 3mL乙醇、2mL乙酸、6mL6mol•L-1盐酸 | 饱和Na2CO3溶液 | 1.2 |
②分析实验A、B、C的数据,可以得出浓硫酸在反应中的作用是催化剂、吸水剂;实验D和实验C对照,你又能得出的结论是对该反应起催化作用的实际上为H+
(4)本实验制备乙酸乙酯的装置与教材装置相比较突出的优点是一是增加了温度计,有利于控制发生装置中反应液的温度,二是增加了冷凝装置,有利于收集产物,三是增加了分水器,能够在反应进行时很容易的把水分离出来,从而使平衡正向移动,提高乙酸乙酯的产率(至少答出两点)