题目内容
20.化学概念之间可能存在如图所示的从属关系:下列有关概念相互关系的说法中正确的是( )
| A. | 化合物与单质属于包含关系 | |
| B. | 化合物与电解质属于交叉关系 | |
| C. | 分散系与胶体属于包含关系 | |
| D. | 氧化还原反应与化合反应属于并列关系 |
分析 A.纯净物可分为化合物与单质;
B.化合物是两种或两种以上的元素组成的纯净物,电解质是在水溶液中或熔融状态下能导电的化合物;
C.分散系都是由两种以上的物质组成混合物,胶体是分散质粒度介于1-100nm之间的分散系;
D.氧化还原反应中必须有元素化合价的改变,化合反应中化合价可能变化,可能不变.
解答 解:A.纯净物按元素的含有情况可分为化合物与单质,是并列关系,故A错误;
B.化合物与电解质属于包含关系,故B错误;
C.分散系与胶体属于包含关系,故C正确;
D.氧化还原反应与化合反应属于交叉关系,故D错误;
故选C.
点评 本题考查了化学基本概念的关系,明确图示的信息及概念的内涵和外延是解本题关键,难度不大.

练习册系列答案
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
10.享誉全球的2008年北京奥运会“祥云”火炬的外壳主要采用高品质的铝合金材料制造,在其燃烧系统内装有主要成分为丙烷的环保型燃料.“祥云”火炬在零风速下火焰高度达25cm~30cm,在强光和日 光情况下均可识别和拍摄.下列有关丙烷的叙述不正确的是( )
| A. | 是直链烃,但分子中碳原子不在一条直线上 | |
| B. | 在光照条件下能够与氯气发生取代反应 | |
| C. | 丙烷比其同分异构体丁烷易液化 | |
| D. | 燃烧时主要是将化学能转变为热能和光能 |
11.(1)Ⅰ.短周期某主族元素M的电离能情况如图A所示,则M元素位于周期表的第ⅡA族;
Ⅱ.图B折线c为某主族元素氢化物的沸点的变化规律,呈现这种变化关系的原因是由于N、O、F电负性大,NH3、H2O、HF因在分子间存在多条结合力较大的氢键,总强度远远大于分子间作用力,故沸点高于同主族其它元素氢化物的沸点,只有ⅣA族元素氢化物不存在反常现象.两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线a和b,你认为正确的是:b(填“a”或“b”)
(2)用氢键表示式写出氨水中NH3分子与水分子间形成的可能存在的氢键N-H…O、O-H…N.
(3)下表列出了含氧酸酸性强弱与非羟基氧原子数的关系.
亚磷酸(H3PO3)也是中强酸,则它的结构式为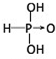 .
.
(4)Cu元素可形成[Cu(NH3)4]SO4,其中存在的化学键类型有①③⑤(填序号).
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键.
Ⅱ.图B折线c为某主族元素氢化物的沸点的变化规律,呈现这种变化关系的原因是由于N、O、F电负性大,NH3、H2O、HF因在分子间存在多条结合力较大的氢键,总强度远远大于分子间作用力,故沸点高于同主族其它元素氢化物的沸点,只有ⅣA族元素氢化物不存在反常现象.两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线a和b,你认为正确的是:b(填“a”或“b”)

(2)用氢键表示式写出氨水中NH3分子与水分子间形成的可能存在的氢键N-H…O、O-H…N.
(3)下表列出了含氧酸酸性强弱与非羟基氧原子数的关系.
| 次氯酸 | 磷酸 | 硫酸 | 高氧酸 | |
| 含氧酸 | Cl-OH | 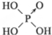 |  | 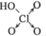 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 .
.(4)Cu元素可形成[Cu(NH3)4]SO4,其中存在的化学键类型有①③⑤(填序号).
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键.
8.化学与科学、技术、社会、环境密切相关.下列有关说法中错误的是( )
| A. | 2010年11月广州亚运会燃放的焰火是某些金属元素焰色反应所呈现出来的色彩 | |
| B. | 为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶 | |
| C. | 小苏打是制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 | |
| D. | 青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是钢铁 |
15.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 54 g Al与足量稀硫酸反应,转移的电子数为6 NA | |
| B. | 标准状况下,1.8 g H2O所占的体积约为2.24 L | |
| C. | 物质的量浓度为0.5 mol•L-1的MgCl2溶液中,含有Cl-个数为NA | |
| D. | 1 mol铁与足量的氯气反应,失去的电子数为2 NA |
5.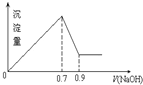 现有AlCl3和Fe2(SO4)3的混合溶液,向其中不断加入 NaOH溶液得到的沉淀的量与加入NaOH溶液的体积的关系如图所示,则原溶液中SO42-与Cl-的物质的量浓度之比为( )
现有AlCl3和Fe2(SO4)3的混合溶液,向其中不断加入 NaOH溶液得到的沉淀的量与加入NaOH溶液的体积的关系如图所示,则原溶液中SO42-与Cl-的物质的量浓度之比为( )
 现有AlCl3和Fe2(SO4)3的混合溶液,向其中不断加入 NaOH溶液得到的沉淀的量与加入NaOH溶液的体积的关系如图所示,则原溶液中SO42-与Cl-的物质的量浓度之比为( )
现有AlCl3和Fe2(SO4)3的混合溶液,向其中不断加入 NaOH溶液得到的沉淀的量与加入NaOH溶液的体积的关系如图所示,则原溶液中SO42-与Cl-的物质的量浓度之比为( )| A. | 3:1 | B. | 1:12 | C. | 3:2 | D. | 6:1 |
12.一定条件下的密闭容器中,起始时投入一定量的SO2(g)和O2(g),发生反应:
2SO2(g)+O2(g)?2SO3(g).t min达到平衡.下列说法不正确的是( )
2SO2(g)+O2(g)?2SO3(g).t min达到平衡.下列说法不正确的是( )
| A. | 若起始时投入2mol SO2与1mol O2,则生成2mol SO3 | |
| B. | 若用18O2进行反应,则一段时间后,18O在反应物和生成物中均存在 | |
| C. | t min前,该反应的正反应速率大于逆反应速率 | |
| D. | 平衡时反应物与生成物浓度均不再变化 |
10.用 NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 5.6 g铁和足量氯气反应时,铁失去的电子数为0.2 NA | |
| B. | 22.4 L甲烷(CH4)所含的原子数为5 NA | |
| C. | 常温常压下,28 g氮气所含的原子数为2NA | |
| D. | 在20℃,1.01×105Pa时,11.2 L氧气所含的原子数为NA |
 已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态.
已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态.