题目内容
15.人体由50多种元素组成,不少元素与我们的身体健康密切相关,摄入不足或摄入过多均不利于人体健康.(1)饮用水中的NO3- 对人类健康会产生危害,为了降低饮用水中NO3- 的浓度,可以在碱性条件下加入铝粉,其化学方程式为:10Al+6NaNO3+4NaOH═10NaAlO2+3N2↑+2H2O.请回答下列问题:
①上述反应中Al元素(填元素符号)的原子失去电子.
②用“单线桥法”表示上述反应中电子转移的方向和数目:

③当电子转移的数目为6.02×1023个时,生成氮气的物质的量为0.1mol.
(2)铁在人体中是发Fe2+ 和Fe3+ 的形式存在.二价亚铁离子易被吸收,给贫血者补血时,应给予含二价铁离子的二价亚铁盐,如硫酸亚铁(FeSO4).
①人体中经常进行转化Fe2+$?_{B}^{A}$Fe3+,B反应中Fe3+做氧化剂.
②服用维生素C,可使食物中的三价铁离子还原成二价铁离子,有利与铁的吸收.这说明维生素C具有还原性.
③很多物质都能氧化二价铁离子,试写出Cl2与FeCl2反应的离子方程式2Fe2++Cl2=2Fe3++2Cl-.
分析 (1)10Al+6NaNO3+4NaOH═10NaAlO2+3N2↑+2H2O中,氮元素化合价从+5价变化为0价2NaNO3~N2~10e-,铝元素化合价从0价变化为+3价,Al~NaAlO2~3e-,依据电子守恒可知生成3molN2,电子转移30mol;
(2)①B反应中,Fe元素的化合价由+3价降低为+2价;
②维生素C,可使食物中的三价铁离子还原成二价铁离子,铁元素的化合价降低;
③Cl2与FeCl2反应生成氯化铁.
解答 解:(1)10Al+6NaNO3+4NaOH═10NaAlO2+3N2↑+2H2O中,氮元素化合价从+5价变化为0价2NaNO3~N2~10e-,铝元素化合价从0价变化为+3价,
①Al元素的化合价升高,则Al失去电子,故答案为:Al;
②该反应中生成3molN2,电子转移30mol,则用“单线桥法”表示电子转移的方向和数目为 ,
,
故答案为: ;
;
③由反应可知生成3molN2,电子转移30mol,则电子转移的数目为6.02×1023个时,生成氮气的物质的量为$\frac{6.02×1{0}^{23}}{{N}_{A}}×\frac{3}{30}$mol=0.1mol,故答案为:0.1mol;
(2)①B反应中,Fe元素的化合价由+3价降低为+2价,则Fe3+做氧化剂,故答案为:氧化;
②维生素C,可使食物中的三价铁离子还原成二价铁离子,铁元素的化合价降低,维生素C中某元素的化合价升高,则维生素C具有还原性,故答案为:还原;
③Cl2与FeCl2反应生成氯化铁,离子反应为2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,题目难度不大.

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案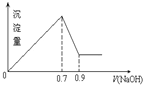 现有AlCl3和Fe2(SO4)3的混合溶液,向其中不断加入 NaOH溶液得到的沉淀的量与加入NaOH溶液的体积的关系如图所示,则原溶液中SO42-与Cl-的物质的量浓度之比为( )
现有AlCl3和Fe2(SO4)3的混合溶液,向其中不断加入 NaOH溶液得到的沉淀的量与加入NaOH溶液的体积的关系如图所示,则原溶液中SO42-与Cl-的物质的量浓度之比为( )| A. | 3:1 | B. | 1:12 | C. | 3:2 | D. | 6:1 |
| A. | 原子个数 | B. | 元素种类 | C. | 元素化合价 | D. | 质量 |
| A. | 产生布朗运动 | B. | 产生丁达尔现象 | ||
| C. | 胶体微粒不能穿透半透膜 | D. | 分散质直径在10-7~10-9m之间 |
| A. | 5.6 g铁和足量氯气反应时,铁失去的电子数为0.2 NA | |
| B. | 22.4 L甲烷(CH4)所含的原子数为5 NA | |
| C. | 常温常压下,28 g氮气所含的原子数为2NA | |
| D. | 在20℃,1.01×105Pa时,11.2 L氧气所含的原子数为NA |
| A. | 手机芯片 | B. | 光导纤维 | C. | 陶瓷餐具 | D. | 石英钟表 |
| A. | Cl2→HClO | B. | Fe2O3→Fe | C. | NH3→NO | D. | H2SO4(浓)→SO2 |
| A. | 溶液中水电离出的H+个数:②>① | |
| B. | Na2CO3溶液中:c(Na+)=2c(CO32-)+c(H2CO3)+c(HCO3-) | |
| C. | ①溶液中:c(CO${\;}_{3}^{2-}$)<c(H2CO3) | |
| D. | ②溶液中:c(HCO${\;}_{3}^{-}$)>c(H2CO3) |
| A. | 三者对应的氧化物均为碱性氧化物 | |
| B. | 三者的单质放置在空气中均只生成氧化物 | |
| C. | 制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 | |
| D. | 冶炼单质Al、Fe、Cu均可采用热还原的方法 |