题目内容
15.设NA表示阿伏加德罗常数,下列说法中不正确的是( )| A. | 53g Na2C03固体中含有的离子数总数为1.5NA | |
| B. | 78 g Na2O2与足量的水充分反应,转移的电子数目为NA | |
| C. | 46 g NO2 和 N2O4混合气体中含有原子数为3NA | |
| D. | 在标准状况下,22.4 L SO3中含原子数为4 NA |
分析 A.1molNa2C03固体含有3mol离子;
B.过氧化钠与足量二氧化碳反应转移电子的物质的量等于反应的过氧化钠的物质的量;
C.NO2和N2O4的最简式均为NO2;
D.三氧化硫在标况下是固体.
解答 解:A.53g Na2C03固体的物质的量为0.5mol,含有的离子物质的量为1.5mol,总数为1.5NA,故A正确;
B.78 g 过氧化钠与足量二氧化碳反应转移电子的物质的量为1mol,因此转移电子数为NA,故B正确;
C.NO2和N2O4的最简式均为NO2,46g NO2和N2O4混合气体中含有NO2的物质的量n=$\frac{46g}{46g/mol}$=1mol,故含有3mol原子,即3NA个,故C正确;
D.标况下,三氧化硫是固体,所以不能使用气体摩尔体积,故D错误.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,易错选项是D,注意气体摩尔体积的使用范围.

练习册系列答案
相关题目
16.下列有关物质用途的说法中,不正确的是( )
| A. | 晶体硅可用于制作光导纤维 | B. | 过氧化钠可作潜水艇中的供氧剂 | ||
| C. | 氢氟酸可用来刻蚀玻璃 | D. | 漂白粉可用作游泳池的消毒剂 |
6.某500mL溶液中含0.1mol Fe2+、0.2mol Fe3+,加入0.2mol铁粉,待Fe3+完全还原后,溶液中Fe2+的物质的量浓度为(假设反应前后体积不变)( )
| A. | 0.4 mol•L-1 | B. | 0.6 mol•L-1 | C. | 0.8 mol•L-1 | D. | 1.0 mol•L-1 |
3.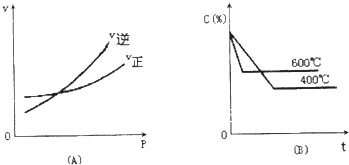 如图中C%表示某反应物在体系中的百分含量,v表示反应速率,P表示压强,t表示反应时间.图(A)为温度一定时,压强与反应速率的关系曲线;图(B)为压强一定时,在不同时间C%与温度的关系曲线.同时符合两个图象的反应是( )
如图中C%表示某反应物在体系中的百分含量,v表示反应速率,P表示压强,t表示反应时间.图(A)为温度一定时,压强与反应速率的关系曲线;图(B)为压强一定时,在不同时间C%与温度的关系曲线.同时符合两个图象的反应是( )
 如图中C%表示某反应物在体系中的百分含量,v表示反应速率,P表示压强,t表示反应时间.图(A)为温度一定时,压强与反应速率的关系曲线;图(B)为压强一定时,在不同时间C%与温度的关系曲线.同时符合两个图象的反应是( )
如图中C%表示某反应物在体系中的百分含量,v表示反应速率,P表示压强,t表示反应时间.图(A)为温度一定时,压强与反应速率的关系曲线;图(B)为压强一定时,在不同时间C%与温度的关系曲线.同时符合两个图象的反应是( )| A. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-808.7kJ/mol | |
| B. | N2O3(g)?NO2(g)+NO(g)△H=+41.8kJ/mol | |
| C. | 3NO2(g)+H2O(l)?2HNO3(l)+NO(g)△H=-261.3kJ/mol | |
| D. | CO2(g)+C(s)?2CO(g)△H=+171.4kJ/mol |
10.享誉全球的2008年北京奥运会“祥云”火炬的外壳主要采用高品质的铝合金材料制造,在其燃烧系统内装有主要成分为丙烷的环保型燃料.“祥云”火炬在零风速下火焰高度达25cm~30cm,在强光和日 光情况下均可识别和拍摄.下列有关丙烷的叙述不正确的是( )
| A. | 是直链烃,但分子中碳原子不在一条直线上 | |
| B. | 在光照条件下能够与氯气发生取代反应 | |
| C. | 丙烷比其同分异构体丁烷易液化 | |
| D. | 燃烧时主要是将化学能转变为热能和光能 |
20.下列物质中属于共价化合物的是( )
| A. | NH4Cl | B. | O2 | C. | Fe | D. | HNO3 |
4.下列不能用勒夏特列原理解释的是( )
| A. | Fe(SCN)3溶液中加入固体KSCN后颜色变深 | |
| B. | 棕红色NO2加压后颜色先变深后变浅 | |
| C. | SO2催化氧化成SO3的反应,往往需要使用催化剂 | |
| D. | FeCl3溶液的配制需先将固体FeCl3溶解在盐酸中,再加水稀释到相应浓度 |

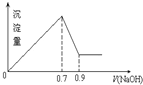 现有AlCl3和Fe2(SO4)3的混合溶液,向其中不断加入 NaOH溶液得到的沉淀的量与加入NaOH溶液的体积的关系如图所示,则原溶液中SO42-与Cl-的物质的量浓度之比为( )
现有AlCl3和Fe2(SO4)3的混合溶液,向其中不断加入 NaOH溶液得到的沉淀的量与加入NaOH溶液的体积的关系如图所示,则原溶液中SO42-与Cl-的物质的量浓度之比为( )