题目内容
14.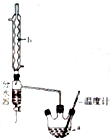 实验室通常以乙醇、乙酸和浓硫酸混合加热制备乙酸乙酯,装置如图所示
实验室通常以乙醇、乙酸和浓硫酸混合加热制备乙酸乙酯,装置如图所示(1)请用同位素示踪法表示乙酸和乙醇发生酯化反应的反应原理
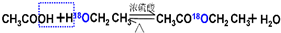
(2)装置中,b的名称为球形冷凝管(冷凝管),其主要作用是冷凝回流;加热前,通常需要在a中加入碎瓷片,目的是防止暴沸
(3)为了证明浓硫酸的作用,某同学进行了以下4个实验,实验开始先用酒精灯微热3min,再加热使之微微沸腾3min,实验结束后测分水器中有机物的厚度,实验记录如表:
| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 有机层厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL 18mol•L-1浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 饱和Na2CO3溶液 | 0.1 |
| C | 3mL乙醇、2mL乙酸、6mL 3mol•L-1硫酸 | 饱和Na2CO3溶液 | 1.2 |
| D | 3mL乙醇、2mL乙酸、6mL6mol•L-1盐酸 | 饱和Na2CO3溶液 | 1.2 |
②分析实验A、B、C的数据,可以得出浓硫酸在反应中的作用是催化剂、吸水剂;实验D和实验C对照,你又能得出的结论是对该反应起催化作用的实际上为H+
(4)本实验制备乙酸乙酯的装置与教材装置相比较突出的优点是一是增加了温度计,有利于控制发生装置中反应液的温度,二是增加了冷凝装置,有利于收集产物,三是增加了分水器,能够在反应进行时很容易的把水分离出来,从而使平衡正向移动,提高乙酸乙酯的产率(至少答出两点)
分析 (1)酯化反应的本质为酸脱羟基,醇脱氢,羧酸中的羧基提供-OH,醇中的-OH提供-H,相互结合生成水;
(2)根据粗产品乙酸乙酯的性质进行解答;乙酸乙醇沸点低,液体加热要加碎瓷片,防止暴沸;
(3)①碳酸钠溶液显示碱性;乙酸乙酯不溶于碳酸钠溶液,混合液分层,颜色不同;
②分析实验A、B、C的数据,可以得出乙酸与乙醇需浓硫酸作催化剂,因该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动;根据实验D和实验C试管Ⅰ中试剂异同分析解答;
(4)根据本实验制备乙酸乙酯的装置与教材装置相比较的异同点分析解答.
解答 解:(1)酯化反应的本质为酸脱羟基,醇脱氢,羧酸中的羧基提供-OH,醇中的-OH提供-H,相互结合生成水,其它基团相互结合生成酯,同时该反应可逆,反应的化学方程式为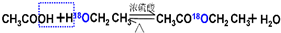 ,
,
故答案为: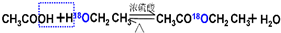 ;
;
(2)装置中,b的名称为球形冷凝管(冷凝管),乙酸乙酯沸点低,易挥发,增加冷凝装置,冷凝回流有利于收集产物,乙酸、乙醇沸点低,液体加热要加碎瓷片,引入汽化中心,可防止溶液暴沸,
故答案为:球形冷凝管(冷凝管);冷凝回流;防止暴沸;
(3)①由于碳酸钠溶液显碱性,能使酚酞试液显红色,所以应该滴入酚酞试液,每次实验结束后可观察到分水器中,实验现象是碳酸钠层(下层)呈红色,上层的酯层呈无色,
故答案为:酚酞;液体分层,上层呈无色,下层呈红色;
②分析实验A、B、C的数据,可以得出乙酸与乙醇发生酯化反应,因该反应为可逆反应,需浓硫酸作催化剂,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,故浓硫酸的作用为催化剂、吸水剂,根据实验D和实验C试管Ⅰ中试剂,不同的是盐酸、硫酸,但两酸氢离子浓度相同,反应后产率相同,说明对该反应起催化作用的实际上为H+,
故答案为:催化剂、吸水剂;对该反应起催化作用的实际上为H+;
(4)教材装置为: ,本实验制备乙酸乙酯的装置与教材装置相比较突出的优点是一是增加了温度计,有利于控制发生装置中反应液的温度,二是增加了冷凝装置,有利于收集产物,三是增加了分水器,能够在反应进行时很容易的把水分离出来,从而使平衡正向移动,提高乙酸乙酯的产率,
,本实验制备乙酸乙酯的装置与教材装置相比较突出的优点是一是增加了温度计,有利于控制发生装置中反应液的温度,二是增加了冷凝装置,有利于收集产物,三是增加了分水器,能够在反应进行时很容易的把水分离出来,从而使平衡正向移动,提高乙酸乙酯的产率,
故答案为:一是增加了温度计,有利于控制发生装置中反应液的温度,二是增加了冷凝装置,有利于收集产物,三是增加了分水器,能够在反应进行时很容易的把水分离出来,从而使平衡正向移动,提高乙酸乙酯的产率.
点评 本题考查乙酸乙酯的制备,题目难度中等,注意理解酯化反应的机理,明确影响反应速率、化学平衡的因素,试题培养了学生分析、理解能力及灵活应用所学知识解决实际问题的能力.

| A. | Fe(SCN)3溶液中加入固体KSCN后颜色变深 | |
| B. | 棕红色NO2加压后颜色先变深后变浅 | |
| C. | SO2催化氧化成SO3的反应,往往需要使用催化剂 | |
| D. | FeCl3溶液的配制需先将固体FeCl3溶解在盐酸中,再加水稀释到相应浓度 |
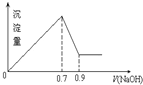 现有AlCl3和Fe2(SO4)3的混合溶液,向其中不断加入 NaOH溶液得到的沉淀的量与加入NaOH溶液的体积的关系如图所示,则原溶液中SO42-与Cl-的物质的量浓度之比为( )
现有AlCl3和Fe2(SO4)3的混合溶液,向其中不断加入 NaOH溶液得到的沉淀的量与加入NaOH溶液的体积的关系如图所示,则原溶液中SO42-与Cl-的物质的量浓度之比为( )| A. | 3:1 | B. | 1:12 | C. | 3:2 | D. | 6:1 |
| A. | 食盐 | B. | 镁 | C. | 氢气 | D. | 淡水 |
| A. | 铁 | B. | 铜 | C. | 银 | D. | 铝 |
| A. | 原子个数 | B. | 元素种类 | C. | 元素化合价 | D. | 质量 |
| A. | 产生布朗运动 | B. | 产生丁达尔现象 | ||
| C. | 胶体微粒不能穿透半透膜 | D. | 分散质直径在10-7~10-9m之间 |
| A. | 溶液中水电离出的H+个数:②>① | |
| B. | Na2CO3溶液中:c(Na+)=2c(CO32-)+c(H2CO3)+c(HCO3-) | |
| C. | ①溶液中:c(CO${\;}_{3}^{2-}$)<c(H2CO3) | |
| D. | ②溶液中:c(HCO${\;}_{3}^{-}$)>c(H2CO3) |
 已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态.
已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态.