题目内容
17.工业上以粗铜为原料采取如图1所示流程制备硝酸铜晶体.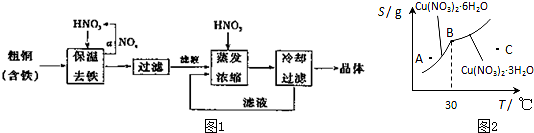
①步骤a中,还需要通入氧气和水,其目的是提高原料利用率,减少污染物的排放.
②根据下表数据,在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在3.2~4.7范围.不用加水的方法调节溶液pH的主要原因是加水会将溶液稀释,不利于将滤液蒸发浓缩.
③进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其原因是(结合离子方程式说明)由于Cu2+发生水解:Cu2++2H2O?Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解.
(2)图2是某小组同学查阅资料所绘出的硝酸铜晶体[Cu(NO3)2•nH2O]的溶解度曲线(温度在30℃前后对应不同的晶体),下列说法正确的是b、d(填字母).
a.A点时溶液为不饱和溶液
b.B点时两种晶体可以共存
c.按上述流程终得到晶体是Cu(NO3)2•3H2O
d.若将C点时的溶液降温至30℃以下,可以析出Cu(NO3)2•6H2O晶体
(3)某些共价化合物(如H2O、NH3、N2O4等)在液态时有微弱的导电性主要是因为发生了电离,如:2NH3?NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应.液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是N2O4?NO++NO3-;Cu与液态N2O4反应制得无水硝酸铜的化学方程是Cu+2N2O4=Cu(NO3)2+2NO↑.
分析 粗铜(含Fe)中加入稀硝酸,Fe、Cu和稀硝酸反应生成Fe(NO3)3、Cu(NO3)2,同时生成氮氧化物,氮氧化物和水反应生成硝酸,能循环利用,调节溶液的pH,将Fe(NO3)3转化为Fe(OH)3沉淀,然后过滤得到滤渣,滤液为Cu(NO3)2溶液,向滤液中加入稀硝酸并调节溶液的pH,然后蒸发浓缩、冷却结晶、过滤洗涤得到硝酸铜晶体.
(1)①NOx污染空气,NOx可与氧气和水反应生成硝酸;
②根据实验目的可知,要让铁离子沉淀完全,铜离子不能形成沉淀,结合表格中的数据可判断PH范围,加水稀释会增大水的质量不利于后续滤液的蒸发结晶操作;
③加热促进铜离子的水解,用硝酸调节溶液的pH=1,增大氢离子浓度可以抑制铜离子的水解程度;
(2)a.在溶解度曲线上方的溶液为过饱和溶液;
b.B点时两种晶体在水溶液中都达到饱和;
c.结晶温度较低,晶体Cu(NO3)2•6H2O析出;
d.若将C点时的溶液降温至30°C以下,如果溶液为过饱和溶液,可以析出Cu(NO3)2•6H2O晶体;
(3)依据2NH3?NH4++NH2-,类推结合题干信息写出电离方程式;从质量守恒的角度书写反应的化学方程式.
解答 解:(1)①NOx可与氧气和水反应生成硝酸,提高了硝酸的利用率,NOx是一类污染性的物质,与氧气和水反应后减少了污染物的排放,保护了环境,
故答案为:提高原料的利用率,减少污染物的排放;
②根据实验目的可知,要让Fe3+沉淀完全,Cu2+不能形成沉淀,氢氧化铁沉淀完全的PH为3.2,氢氧化铜开始沉淀时的pH为4.7,要让Fe3+沉淀完全,Cu2+不形成沉淀,溶液的PH应保持在3.2~4.7之间的范围;加水会使得溶液中溶剂的质量增加,将增大滤液蒸发结晶操作的难度,
故答案为:3.2~4.7;加水会将溶液稀释,不利于将滤液蒸发浓缩;
③进行蒸发浓缩时,温度较高,促进了铜离子的水解,Cu2++2H2O?Cu(OH)2+2H+,用硝酸调节溶液的pH=1,增大氢离子浓度可以水解平衡逆向移动,抑制铜离子的水解,
故答案为:由于Cu2+发生水解:Cu2++2H2O?Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解;
(2)a.在一定温度下,某固态物质在100g溶剂中达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂中的溶解度溶解度,在溶解度曲线上方的溶液为过饱和溶液,可知图中曲线所有的点均为对应温度下的饱和溶液,故a错误;
b.B点表明在30℃时两种晶体的溶解度相等,B点为生成晶体的转折点,两种晶体可以共存,故b正确;
c.上述流程是在低温下进行的.最终得到的晶体是Cu(NO3)2•6H2O,故c错误;
d.由图象可以看出,溶液降温至30℃以下,可以析出Cu(NO3)2•6H2O晶体,故d正确,
故答案为:bd.
(3)液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是;N2O4?NO++NO3-;Cu与液态N2O4反应制得无水硝酸铜,根据质量守恒和电子守恒可写出反应的化学方程式为Cu+2N2O4=Cu(NO3)2+2NO↑,
故答案为:N2O4?NO++NO3-;Cu+2N2O4=Cu(NO3)2+2NO↑.
点评 本题以铜和酸的反应为载体考查混合物的分离和提纯,根据物质的性质、基本操作从整体上分析流程图中各个步骤发生的反应,知道图2中曲线上、下区域表示的含义,注意盐类水解的影响因素,题目难度中等.

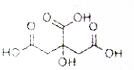 物质X的结构式如图所示,常被用于香料或作为饮料的酸化剂,在食品和医学上用作多价整合剂,也是化学中间体.下列关于物质X的说法正确的是( )
物质X的结构式如图所示,常被用于香料或作为饮料的酸化剂,在食品和医学上用作多价整合剂,也是化学中间体.下列关于物质X的说法正确的是( )| A. | X分子式C6H7O7 | |
| B. | 1mol物质X可以和3mol氢气发生加成 | |
| C. | X可以发生氧化反应、取代反应和消去反应 | |
| D. | 1molX分别与足量的NaHCO3、Na反应得到的气体体积比为3:2 |
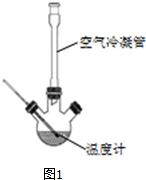 肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料.实验室用下列反应制取肉桂酸.
肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料.实验室用下列反应制取肉桂酸.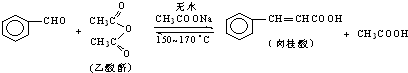
药品物理常数
| 苯甲醛 | 乙酸酐 | 肉桂酸 | 乙酸 | |
| 溶解度(25℃,g/100g水) | 0.3 | 遇热水水解 | 0.04 | 互溶 |
| 沸点(℃) | 179.6 | 138.6 | 300 | 118 |
| 相对分子质量 | 106 | 102 | 148 | 60 |
Ⅰ、合成:反应装置如图1所示.向三颈烧瓶中先后加入研细的无水醋酸钠、4.8g苯甲醛和5.6g乙酸酐,振荡使之混合均匀.在150~170℃加热1小时,保持微沸状态.
(1)空气冷凝管的作用是使反应物冷凝回流.
(2)该装置的加热方法是空气浴(或油浴).加热回流要控制反应呈微沸状态,如果剧烈沸腾,会导致肉桂酸产率降低,可能的原因是乙酸酐蒸出,反应物减少,平衡左移.
(3)不能用醋酸钠晶体(CH3COONa•3H2O)的原因是乙酸酐遇热水水解.
Ⅱ、粗品精制:将上述反应后得到的混合物趁热倒入圆底烧瓶中,进行下列操作:

(4)加饱和Na2CO3溶液除了转化醋酸,主要目的是将肉桂酸转化为肉桂酸钠,溶解于水.
(5)操作I是冷却结晶;若所得肉桂酸晶体中仍然有杂质,欲提高纯度可以进行的操作是重结晶(均填操作名称).
(6)设计实验方案检验产品中是否含有苯甲醛取样,加入银氨溶液共热,若有银镜出现,说明含有苯甲醛,或加入用新制氢氧化铜悬浊液,若出现砖红色沉淀,说明含有苯甲醛.
(7)若最后得到纯净的肉桂酸5.0g,则该反应中的产率是75%(保留两位有效数字)
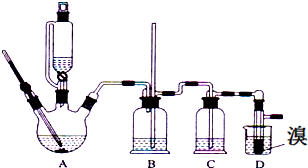
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
(1)用少量的溴和足量的乙醇、浓硫酸制备1,2-二溴乙烷的两步反应方程式为:CH3CH2OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;CH2=CH2+Br-Br→CH2Br-CH2Br
(2)装置B中玻璃管的作用控制气体流速,防止危险
(3)装置C中加入氢氧化钠溶液,其目的是吸收反应中生成的SO2、CO2气体 (填分子式)
(4)反应过程中应用冷水冷却装置D,其主要目的是避免溴大量挥发;但又不能过度冷却(如用冰水),其原因是产品1,2-二溴乙烷的熔点(凝固点)低,过度冷却会凝固而堵塞导管.
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(6)若产物中有少量未反应的Br2,最好用NaOH溶液试剂除去;
(7)若产物中有少量副产物乙醚.可用蒸馏方法除去.
| A. | pH=4的醋酸 | B. | pH=10的NaOH溶液 | ||
| C. | pH=9的Na2CO3溶液 | D. | pH=2的硫酸 | ||
| E. | pH=4的NH4Cl溶液 |
| A. | 质子数为7、中子数为7的氮原子:${\;}_{7}^{7}$N | |
| B. | 氮离子(N3-)的结构示意图: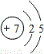 | |
| C. | 氨气分子的电子式: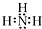 | |
| D. | 甘氨酸分子的结构简式:C2H5O2N |
| Na2CO3的质量 | 关于O2的描述 | |
| A | 21.2g | O2的摩尔质量是36g•mol-1 |
| B | 21.6g | 生成标准状况下O2的体积为2.24L |
| C | 21.6g | O2的摩尔质量是34g•mol-1 |
| D | 22.4g | 生成标准状况下O2的体积为2.24L |
| A. | A | B. | B | C. | C | D. | D |