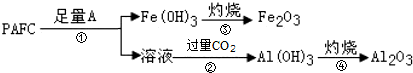
题目内容
20.在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1molXY2含有54mol电子.(1)该融雪剂的化学式是CaCl2;用电子式表示该物质形成
 .
. (2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是
 ;D与E能形成一种所有原子最外层均满足8电子的分子,该分子的结构式为S=C=S;D所在族元素的氢化物中,沸点最低的是H2S.
;D与E能形成一种所有原子最外层均满足8电子的分子,该分子的结构式为S=C=S;D所在族元素的氢化物中,沸点最低的是H2S.(3)元素W与Y同周期,其单质是原子晶体;元素Z的单质分子Z2中有3个共价键;W与Z能形成一种新型无机非金属材料,其化学式是Si3N4.
分析 (1)融雪剂主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,含有相同的核外电子数,且1molXY2含有54mol电子,则阴、阳离子核外电子数为$\frac{54}{3}$=18,则为Ca2+、Cl-,故XY2是CaCl2;
氯化钙属于离子化合物,由钙离子与氢氧根离子构成,用Ca、Cl原子电子式表示其形成;
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与氯元素相邻,则D为硫元素;E有2个电子层,最外层电子数为4,则E为碳元素,碳元素与硫元素形成所有原子最外层均满足8电子的分子为CS2,与二氧化碳结构类似;
D处于ⅥA族,根据晶体结构与氢键判断同主族中氢化物沸点高低;
(3)元素W与Cl元素同周期,其单质是原子晶体,则W为Si元素;元素Z的单质分子Z2中有3个共价键,则Z为氮元素.
解答 解:(1)融雪剂主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,含有相同的核外电子数,且1molXY2含有54mol电子,则阴、阳离子核外电子数为$\frac{54}{3}$=18,则为Ca2+、Cl-,故XY2是CaCl2,用电子式表示其形成过程为: ,
,
故答案为:CaCl2; ;
;
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与氯元素相邻,则D为硫元素,D的离子结构示意图是 ;E有2个电子层,最外层电子数为4,则E为碳元素,碳元素与硫元素形成所有原子最外层均满足8电子的分子为CS2,与二氧化碳结构类似,其结构式为:S=C=S;氧族元素中氢化物为分子晶体(Po除外),而水分子之间存在氢键,沸点最高,硫化氢相对分子质量小于硒化氢、碲化氢,H2S分子间作用力较小,故H2S的沸点最低,
;E有2个电子层,最外层电子数为4,则E为碳元素,碳元素与硫元素形成所有原子最外层均满足8电子的分子为CS2,与二氧化碳结构类似,其结构式为:S=C=S;氧族元素中氢化物为分子晶体(Po除外),而水分子之间存在氢键,沸点最高,硫化氢相对分子质量小于硒化氢、碲化氢,H2S分子间作用力较小,故H2S的沸点最低,
故答案为: ;S=C=S;H2S;
;S=C=S;H2S;
(3)元素W与Cl元素同周期,其单质是原子晶体,则W为Si元素;元素Z的单质分子Z2中有3个共价键,则Z为氮元素,Si与N形成一种新型无机非金属材料为Si3N4,
故答案为:Si3N4.
点评 本题考查结构性质位置关系、常用化学用语、物质结构与性质等,难度不大,注意氢键对物质性质的影响.

 阅读快车系列答案
阅读快车系列答案| A. | 40 | B. | 41 | C. | 42 | D. | 48 |
| A. | 与氢气反应的难易程度 | B. | 氢化物的熔沸点 | ||
| C. | 非金属性的强弱 | D. | 氢化物稳定性 |
| A. | 乙二醇的水溶液凝固点很低,可作汽车发动机的抗冻剂 | |
| B. | 丙三醇的沸点比乙二醇的沸点高,可用于配制化妆品 | |
| C. | 这两种多元醇都易溶于水,但难溶于有机溶剂 | |
| D. | 丙三醇可以制造炸药,乙二醇是制涤纶的主要原料 |

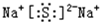 ,BA2的结构式是:S=C=S.
,BA2的结构式是:S=C=S.
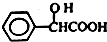 .工业上扁桃酸可以由烃A经过以下步骤合成得到:
.工业上扁桃酸可以由烃A经过以下步骤合成得到: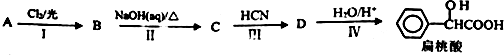
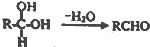
 ;扁桃酸中含氧官能团名称羟基、羧基.
;扁桃酸中含氧官能团名称羟基、羧基. .
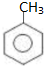
. )在浓硫酸作用下反应生成,请写出反应的化学方程式
)在浓硫酸作用下反应生成,请写出反应的化学方程式
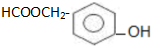 .
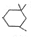
.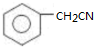 )为原料合成扁桃酸的同分异构体-对羟基苯乙酸(
)为原料合成扁桃酸的同分异构体-对羟基苯乙酸( )的合理路线.
)的合理路线.