题目内容
7.在反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中,若有8.7g MnO2参加反应,则被氧化的HCl的质量为( )| A. | 14.6g | B. | 7.3g | C. | 3.65g | D. | 0.73g |
分析 n(MnO2)=$\frac{8.7g}{87g/mol}$=0.1mol,根据方程式知,该反应中只有一半的HCl被氧化,根据二氧化锰和被氧化HCl的关系式计算被氧化HCl的物质的量,再根据m=nM计算其质量.
解答 解:n(MnO2)=$\frac{8.7g}{87g/mol}$=0.1mol,根据方程式知,该反应中只有一半的HCl被氧化,所以被氧化n(HCl)=2n(MnO2)=2×0.1mol=0.2mol,被氧化m(HCl)=0.2mol×36.5g/mol=7.3g,故选B.
点评 本题考查氧化还原反应有关计算,明确各个物理量之间的关系式即可解答,注意该反应中HCl的作用,题目难度不大.

练习册系列答案
相关题目
17.下列定律或原理:①质量守恒定律,②能量守恒定律,③元素周期律,④勒夏特列原理,其中能够适用于2NH3(g)?N2(g)+3H2(g)△H<0这一化学反应的是( )
| A. | 只有④ | B. | ①和③ | C. | ①②④ | D. | ①②③ |
2.有机物C4H8O3在一定条件下的性质有:在浓硫酸存在下,可脱水生成能使溴水褪色的只有一种结构形式的有机物,在浓硫酸存在下,能分别与乙醇或乙酸反应,在浓硫酸存在下,还能生成分子式为C4H6O2的五元环状有机物,则有机物C4H8O3的有关叙述正确的是( )
| A. | C4H8O3的结构简式为HOCH2CH2CH2COOH | |
| B. | C4H8O3的结构简式为CH3CH(OH)CH2COOH | |
| C. | C4H8O3为α-羟基丁酸 | |
| D. | C4H8O3为羟基乙酸乙酯 |
19.下列对应化学反应的离子方程式正确的是( )
| A. | 向磷酸二氢铵溶液中加入足量氢氧化钠溶液:NH4++OH-═NH3•H2O | |
| B. | 向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+═Fe2++2H2O | |
| C. | FeSO4溶液在空气中放置变质:4Fe2++O2+2H2O═4Fe3++4OH- | |
| D. | 过量SO2通入冷氨水中:SO2+NH3•H2O=HSO3-+NH4+ |
17.已知燃烧7.80g乙炔气体生成二氧化碳气体和液态水时,放出389.9kJ的热量,则下列有关乙炔气体燃烧的热化学方程式中,正确的是( )
| A. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-389.9kJ•mol-1 | |
| B. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=+2599.2kJ•mol-1 | |
| C. | C2H2(g)+$\frac{5}{2}$O2(g)═2CO2(g)+H2O(l)△H=-1299.6kJ•mol-1 | |
| D. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-1299.6kJ•mol-1 |

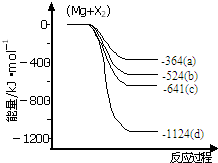 镁化合物具有广泛用途,请回答有关镁的下列问题:
镁化合物具有广泛用途,请回答有关镁的下列问题: