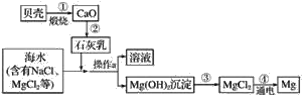
题目内容
【题目】反应A(g)![]() B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
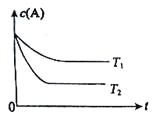
(1)上述反应的温度T1___ T2,平衡常数K(T1)___K(T2)。(填“大于”、“小于” 或“等于”)
(2)若温度T2时,5min后反应达到平衡,A的转化率为70%,则:
①平衡时体系总的物质的量为_______。
②反应的平衡常数K=______。
③反应在0~5min区间的平均反应速率v(A)=_______。
【答案】小于 小于 0.085mol 0.082mol/L 0.007mol/(L·min)
【解析】
(1)由图可知,温度为T2时反应先达到平衡状态,温度越高,反应速率越快,达到平衡所需的时间越短,所以T1小于T2;据图可知,温度为T2时c(A)小,说明升高温度平衡正向移动,所以正反应为吸热反应,温度越高K值越大,故答案为:小于;小于;
(2) A(g)![]() B(g)+C(g)
B(g)+C(g)
起始浓度:0.050 0 0
变化浓度:0.035 0.035 0.035
平衡浓度:0.015 0.035 0.035
①平衡时体系总的物质的量为=(0.015+0.035+0.035)mol/L×1L=0.085mol;
②K=![]() =0.082mol/L;
=0.082mol/L;
③反应在0~5min区间的平均反应速率v(A)=![]() =0.007mol/(Lmin);
=0.007mol/(Lmin);

【题目】下列A~D四组反应中,Ⅰ和Ⅱ可用同一个离子方程式表示的是( )
选项 | Ⅰ | Ⅱ |
A | 把金属铁放入稀硫酸中 | 把金属铁放入稀硝酸中 |
B | 氯化铝溶液中加入少量的NaOH溶液 | NaOH溶液中加入少量的氯化铝溶液 |
C | 稀硫酸中加入少量的氢氧化钡溶液 | 氢氧化钡溶液中加入少量的稀硫酸 |
D | 将少量Na2CO3溶液滴入足量HCl溶液中 | 将少量HCl溶液滴入足量Na2CO3溶液中 |
A.AB.BC.CD.D