题目内容
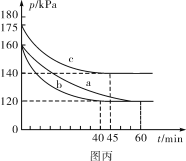
【题目】反应2SO2(g)+O2(g)![]() 2SO3(g)在容积为2L的密闭容器中进行,初始时向容器里充入4molSO2和2mol18O2,在T1和T2温度下,SO3的物质的量与时间关系如图所示。请回答下列问题:
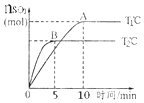
2SO3(g)在容积为2L的密闭容器中进行,初始时向容器里充入4molSO2和2mol18O2,在T1和T2温度下,SO3的物质的量与时间关系如图所示。请回答下列问题:
(1)反应后18O原子存在于哪些物质中___(填化学式)。
(2)上述反应的温度T1___ T2(填“>”“<”或“=”)。
(3)若温度T2时,5min后反应达到平衡,SO2的转化率为90%,则:
①平衡时体系内所含物质总的物质的量为___。
②平衡时SO3的浓度为___。
③下列说法不正确的是___。
A.如在该反应体系中加入适当的催化剂,可加快化学反应速率
B.其它条件相同时,该反应在T1时生成SO3的速率比T2时的小
C.该反应到达平衡时,体系内各组分的体积分数保持不变
D.若密闭容器中混合气体密度不变,则该反应达到化学平衡状态
【答案】SO2、O2、SO3 < 4.2mol 1.8molL-1 D
【解析】
(1)根据该反应为可逆反应分析判断;
(2)根据T2建立平衡需要的时间短,反应速率快分析判断;
(3)若温度T2时,5min后反应达到平衡,SO2的转化率为90%,转化的二氧化硫为4mol×90%=3.6mol,结合三段式分析计算,据此分析解答①和②;③A.使用催化剂加快反应速率;B.温度高,反应速率快;C.平衡时,各组分的含量、浓度均不变;D.根据2SO2(g)+O2(g)![]() 2SO3(g)的反应特点分析判断。
2SO3(g)的反应特点分析判断。
(1)该反应为可逆反应,含氧元素的物质均存在18O原子,则反应后18O原子存在于SO2、O2、SO3中,故答案为:SO2、O2、SO3;
(2)由图可知,T2的时间短,反应速率快,先建立平衡,则T2大,可知T1<T2,故答案为:<;
(3)若温度T2时,5min后反应达到平衡,SO2的转化率为90%,转化的二氧化硫为4mol×90%=3.6mol,则
2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
开始(mol) 4 2 0
转化(mol) 3.6 1.8 3.6
平衡(mol) 0.4 0.2 3.6
①平衡时物质的量为0.4mol+0.2mol+3.6mol=4.2mol,故答案为:4.2mol;
②平衡时SO3的浓度为![]() =1.8molL-1,故答案为:1.8molL-1;
=1.8molL-1,故答案为:1.8molL-1;
③A.使用催化剂加快反应速率,则在该反应体系中加入适当的催化剂,可加快化学反应速率,故A正确;B.温度高,反应速率快,则其它条件相同时,该反应在T1时生成SO3的速率比T2时的小,故B正确;C.平衡时,各组分的含量、浓度均不变,则反应到达平衡时,体系内各组分的体积分数保持不变,故C正确;D.2SO2(g)+O2(g)![]() 2SO3(g)在容积为2L的密闭容器中进行,气体的质量m、气体的体积V均不变,则密度始终不变,因此密度不变不能判定是否为平衡状态,故D错误;故选D。
2SO3(g)在容积为2L的密闭容器中进行,气体的质量m、气体的体积V均不变,则密度始终不变,因此密度不变不能判定是否为平衡状态,故D错误;故选D。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案