��Ŀ����
����Ŀ�������£������й�������ȷ����
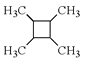
A. ��0.1 mol��L1 Na2CO3��Һ��ͨ������CO2�����c(Na+)=2[c(![]() )+c(
)+c(![]() )+c(H2CO3)]
)+c(H2CO3)]
B. �����£�pH=6��NaHSO3��Һ�У�c(![]() )c(H2SO3)=9.9��107 mol��L1
)c(H2SO3)=9.9��107 mol��L1
C. �����ʵ���Ũ�ȡ��������Na2CO3��NaHCO3��ϣ�![]() <
<![]()
D. 0.1 mol��L1 Na2C2O4��Һ��0.1 mol��L1 HCl��Һ�������ϣ�H2C2O4Ϊ��Ԫ���ᣩ��2c(![]() )+c(
)+c(![]() )+c(OH)=c(Na+)+c(H+)
)+c(OH)=c(Na+)+c(H+)
���𰸡�B
����������0.1 mol��L1 Na2CO3��Һ��ͨ������CO2���������Ϊ̼���ƺ�̼�����ƻ��Һ��̼�����ƣ����������غ��֪��c(Na+)<2[c(![]() )+c(
)+c(![]() )+c(H2CO3)]��A�������£�pH=6��NaHSO3��Һ�У�����غ�Ϊc(H+)+c(Na+)=c(OH)+2c(
)+c(H2CO3)]��A�������£�pH=6��NaHSO3��Һ�У�����غ�Ϊc(H+)+c(Na+)=c(OH)+2c(![]() )+c(
)+c(![]() )�������غ�Ϊc(Na+)=c(
)�������غ�Ϊc(Na+)=c(![]() )+ c(
)+ c(![]() )+ c(H2SO3)���������غ��ϵʽ��ȥ�����ӵ�Ũ�ȿɵã�c(
)+ c(H2SO3)���������غ��ϵʽ��ȥ�����ӵ�Ũ�ȿɵã�c(![]() )c(H2SO3)=c(H+)c(OH)=1��106 mol��L1
)c(H2SO3)=c(H+)c(OH)=1��106 mol��L1
1��108 mol��L1=9.9��107 mol��L1��B��ȷ������̼��������ӡ�̼��ĵ���ƽ�ⳣ���ɵã�c(![]() )/c(H2CO3)=K(H2CO3)/c(H+)��c(
)/c(H2CO3)=K(H2CO3)/c(H+)��c(![]() )/c(
)/c(![]() )=K(
)=K(![]() )/c(H+)������ͬһ��Һ�У���������Ũ����ͬ������̼��ĵ���ƽ�ⳣ������̼��������ӿ�֪��c(
)/c(H+)������ͬһ��Һ�У���������Ũ����ͬ������̼��ĵ���ƽ�ⳣ������̼��������ӿ�֪��c(![]() )/c(H2CO3)=K(H2CO3)/c(H+)>c(
)/c(H2CO3)=K(H2CO3)/c(H+)>c(![]() )/c(
)/c(![]() )=K(
)=K(![]() )/c(H+)��C����0.1 mol��L1 Na2C2O4��Һ��0.1 mol��L1 HCl��Һ�������ϣ�H2C2O4Ϊ��Ԫ���ᣩ���ɵ���غ��֪2c(
)/c(H+)��C����0.1 mol��L1 Na2C2O4��Һ��0.1 mol��L1 HCl��Һ�������ϣ�H2C2O4Ϊ��Ԫ���ᣩ���ɵ���غ��֪2c(![]() )+c(
)+c(![]() )+c(OH)+ c(Cl)=c(Na+)+c(H+)��D����
)+c(OH)+ c(Cl)=c(Na+)+c(H+)��D����

����Ŀ��ʵ���ǻ�ѧѧϰ�зdz���Ҫ�����ݣ�������������ʵ��ش����⡣
��һ��ij�о�С�����Mg(OH)2�����ܽ�����ɵ�ʵ��̽����
���������ϣ�25��ʱ��Ksp[Mg(OH)2]��1.8��10-11��Ksp[Fe(OH)3]��4.0��10-38
��ʵ��̽������2֧��ʢ��1mL0.1mol/LMgCl2��Һ���Թ��зֱ����2��2mol/L NaOH��Һ���Ƶõ���Mg(OH)2������
��1���ֱ�����֧�Թ��м��벻ͬ�Լ�����¼ʵ�����������(�������������ѡ������ĸ����)
�Թܱ�� | �����Լ� | ʵ������ |
�� | 2��0.1mol/LFeCl3��Һ | ��_____ |
�� | 4mL2mol/LNH4Cl��Һ | ��_____ |
A.��ɫ����ת��Ϊ���ɫ���� B.��ɫ�����������ı�
C.���ɫ����ת��Ϊ��ɫ���� D.��ɫ�����ܽ⣬����ɫ��Һ
��2��ͬѧ�Dz���ʵ����г����ܽ����Ҫԭ�������֣�
����1��NH4+���Mg(OH)2�������OH����ʹMg(OH)2���ܽ�ƽ�������ƶ���
����2��____________________________________________________________��
��3��Ϊ��֤���룬ͬѧ��ȡ������ͬ������������þʢ������֧�Թ��У�һ֧�Թ��м���������Һ(pH��7)����һ֧�Թ��м���NH4Cl�Ͱ�ˮ���Һ(pH��8)�����߳������ܽ⡣��ʵ��֤��������ȷ����____���� ��1����2������
�������ⶨijƷ�Ƶĵ���(���е����)�е�Ԫ�صİٷֺ�����ȷ��ȡ5.000 0 g�õ��Σ���������ˮ��Ȼ����������KI��Һ�����������»��(�����ķ�ӦΪKIO3��3H2SO4��5KI===3K2SO4��3I2��3H2O)����ַ�Ӧ�����Һϡ����250 mL��Ȼ��ȡ25.00 mL��5.0��10��4 mol��L��1��Na2S2O3����Һ���еζ�(�õ�����ָʾ������ӦΪI2��2S2O32��===2I����S4O62��)���й�ʵ����ֵ���±���ʾ��
�ζ����� | ����Һ�����(mL) | �ζ�ǰ�Ķ���(mL) | �ζ���Ķ���(mL) |
��һ�� | 25.00 | 0.00 | 15.90 |
�ڶ��� | 25.00 | 0.00 | 14.99 |
������ | 25.00 | 0.00 | 15.01 |
�õ����е�Ԫ�صİٷֺ���Ϊ________����������λ��Ч���֣����в����У��ᵼ������õĵ�Ԫ�صİٷֺ���ƫ�����________��
a���ζ���ʱ�����ӿ̶�
b��û����Na2S2O3����Һ��ϴ��Ӧ�ĵζ���
c����ƿ��������������ˮ