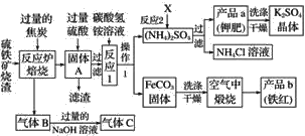
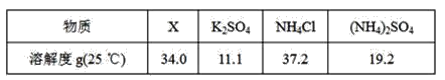
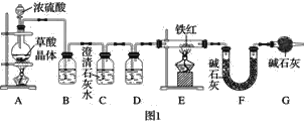
题目内容
【题目】下列A~D四组反应中,Ⅰ和Ⅱ可用同一个离子方程式表示的是( )
选项 | Ⅰ | Ⅱ |
A | 把金属铁放入稀硫酸中 | 把金属铁放入稀硝酸中 |
B | 氯化铝溶液中加入少量的NaOH溶液 | NaOH溶液中加入少量的氯化铝溶液 |
C | 稀硫酸中加入少量的氢氧化钡溶液 | 氢氧化钡溶液中加入少量的稀硫酸 |
D | 将少量Na2CO3溶液滴入足量HCl溶液中 | 将少量HCl溶液滴入足量Na2CO3溶液中 |
A.AB.BC.CD.D
【答案】C
【解析】
A.铁和稀硫酸反应生成硫酸亚铁和氢气,离子方程式为Fe+2H+=Fe2++H2↑,铁和足量稀硝酸反应生成硝酸铁、一氧化氮、水,离子方程式为Fe+![]() +4H+=Fe3++NO↑+2H2O,不能用同一个离子方程式表示,故不选A;
+4H+=Fe3++NO↑+2H2O,不能用同一个离子方程式表示,故不选A;
B.氯化铝溶液中加入少量的NaOH溶液生成氢氧化铝沉淀和氯化钠,离子方程式为Al3++3OH-=Al(OH)3↓,NaOH溶液中加入少量的氯化铝溶液生成偏铝酸钠和氯化钠,离子方程式为Al3++4OH-=![]() +2H2O,不能用同一个离子方程式表示,故不选B;
+2H2O,不能用同一个离子方程式表示,故不选B;
C.稀硫酸中加入少量的氢氧化钡溶液、氢氧化钡溶液中加入少量的稀硫酸,都可用离子方程式Ba2++2OH-+![]() +2H+=BaSO4↓+2H2O表示,故选C;
+2H+=BaSO4↓+2H2O表示,故选C;
D.将少量Na2CO3溶液滴入足量HCl溶液中生成氯化钠、二氧化碳、水,离子方程式为2H++![]() =CO2↑+H2O,将少量HCl溶液滴入足量Na2CO3溶液中生成碳酸氢钠、氯化钠,离子方程式为H++
=CO2↑+H2O,将少量HCl溶液滴入足量Na2CO3溶液中生成碳酸氢钠、氯化钠,离子方程式为H++![]() =
=![]() ,不能用同一个离子方程式表示,故不选D;
,不能用同一个离子方程式表示,故不选D;
选C。

 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案【题目】某学生欲用已知物质的量浓度的盐酸(0.1000mol/L)来测定未知物质的量浓度的NaOH溶液,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握_______(填“酸式”或“碱式”)滴定管的活塞,右手摇动锥形瓶,眼睛注视______________________直到加入最后一滴盐酸后,溶液由黄色变为_________色,并_________________________为止。
(2)滴定开始和结束时滴定管的液面如图所示,则终点读数为_____mL;所用盐酸体积为_____mL。
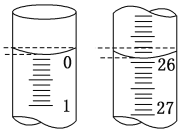
(3)对下列几种假设情况进行讨论:(填“偏高”、“偏低”或“无影响”)
①若滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥,则可能使所测NaOH溶液的浓度数值_________;
②若酸式滴定管在滴定前有气泡,滴定后气泡消失,则可能使所测NaOH溶液的浓度数值_______。
(4)有关数据记录如下:
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 20.00 | 0.50 | 25.40 |
第二次 | 20.00 | 0.00 | 25.10 |
根据所给数据,计算出待测NaOH溶液的浓度为__________________________________。
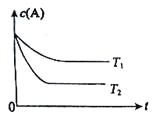
【题目】中和热的测定实验中取![]() 的NaOH溶液50mL与
的NaOH溶液50mL与![]() 的硫酸50mL置于下图所示的装置中,进行中和热的测定实验,回答下列问题:
的硫酸50mL置于下图所示的装置中,进行中和热的测定实验,回答下列问题:
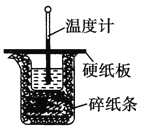
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 ______ ;
(2)大烧杯上如不盖硬纸板,求得的中和热数值____![]() 填“偏大”、“偏小”或“无影响”
填“偏大”、“偏小”或“无影响”![]() ;
;
(3)若![]() 溶液和
溶液和![]() 硫酸溶液的密度都是
硫酸溶液的密度都是![]() ,中和后生成溶液的比热容
,中和后生成溶液的比热容![]() ,通过以下数据计算中和热
,通过以下数据计算中和热![]() _______
_______![]() 结果保留小数点后一位
结果保留小数点后一位![]() 。
。
温度实验次数 | 起始温度 | 终止温度 | ||
| NaOH | 平均值 | ||
1 |
|
|
|
|
2 |
|
|
|
|
3 |
|
|
|
|
4 |
|
|
|
|
(4)如果用![]() 盐酸与
盐酸与![]() 溶液进行反应,与上述实验相比,所放出的热量____
溶液进行反应,与上述实验相比,所放出的热量____![]() 填“相等、不相等”
填“相等、不相等”![]() ,所求中和热____
,所求中和热____![]() 填“相等、不相等”
填“相等、不相等”![]() 。
。
(5)用相同浓度和体积的氨水![]() 代替NaOH溶液进行上述实验,测得的中和热的数值会____。
代替NaOH溶液进行上述实验,测得的中和热的数值会____。![]() 填“偏大”、“偏小”、“无影响”
填“偏大”、“偏小”、“无影响”![]() 。
。