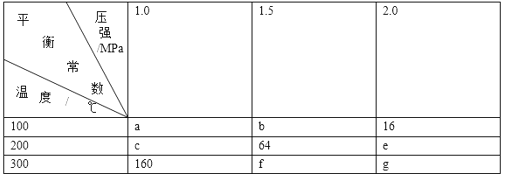
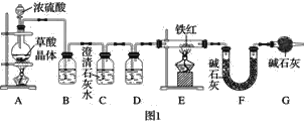
题目内容
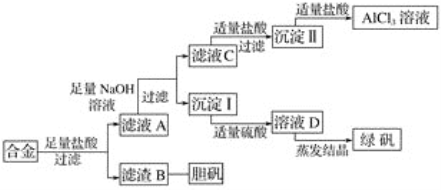
【题目】综合利用海水制备金属镁的流程如图所示,请据图回答下列问题:
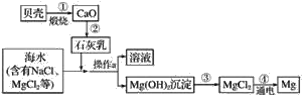
(1)贝壳主要成分的化学式是__。
(2)第②步是用生石灰和水反应制取石灰乳(主要成分是氢氧化钙)请写出制取石灰乳的化学方程式:__,基本反应类型是__。
(3)第③步是将沉淀出的氢氧化镁与盐酸反应生成氯化镁,写出该反应的化学方程式:__,该反应基本类型是__。
(4)第④步是无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式:___,反应基本类型是__。
(5)要使海水中MgCl2完全转化为沉淀Mg(OH)2,加入石灰乳的量应过量,确定海水中的MgCl2已全部转化为Mg(OH)2的方法:取上层清液少量,向其中加入氢氧化钠溶液,观察到__。
(6)海水中本来就有氯化镁,请分析从海水中制取MgCl2时,要经历“MgCl2→Mg(OH)2→MgCl2”的转化原因:__。
【答案】CaCO3 CaO+H2O=Ca(OH)2 化合反应 Mg(OH)2+2HCl=MgCl2+2H2O 复分解反应 MgCl2![]() Mg+Cl2↑ 分解反应 没有沉淀生成 海水中氯化镁含量低,通过转化使溶液中的氯化镁富集
Mg+Cl2↑ 分解反应 没有沉淀生成 海水中氯化镁含量低,通过转化使溶液中的氯化镁富集
【解析】
根据已有的知识进行分析,贝壳的主要成分是碳酸钙;
氧化钙能与水反应生成氢氧化钙;
氢氧化镁能和盐酸反应生成氯化镁和水以及基本的反应类型进行解答;
根据物质的分离与鉴别的方法分析;
根据转化流程的原理与目的分析。
(1)贝壳的主要成分是碳酸钙,它的化学式是CaCO3;
(2)氧化钙和水反应生成氢氧化钙,反应的化学方程式为CaO+H2O=Ca(OH)2,反应类型为化合反应;
(3)氢氧化镁能和盐酸反应生成氯化镁和水,反应的化学方程式为Mg(OH)2+2HCl=MgCl2+2H2O;
(4)电解氯化镁的化学方程式为MgCl2![]() Mg+Cl2↑,反应类型为分解反应;
Mg+Cl2↑,反应类型为分解反应;
(5)要使海水中MgCl2完全转化为沉淀Mg(OH)2,加入石灰乳的量应过量;确定海水中的MgCl2已全部转化为Mg(OH)2的方法是取上层清液少量,向其中加入氢氧化钠溶液,若无沉淀生成则证明无氯化镁;
(6)海水中氯化镁的浓度低,经历以上转化的目的是使溶液中的氯化镁富集。

【题目】实验室可利用环己醇的氧化反应制备环己酮,反应原理和实验装置(部分夹持装置略去)如下:

有关物质的物理性质见下表。
物质 | 沸点(℃) | 密度(g/cm3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
水 | 100.0 | 1.0 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10mL环己醇的A中,在55~65℃进行反应。反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)仪器D的名称为_____。
(2)①滴加酸性Na2Cr2O7溶液时反应的离子方程式为______________;
②蒸馏不能分离环己酮和水的原因是_____。
(3)环己酮需要经过以下操作提纯:
a.往液体中加入NaCl固体至饱和,静置,分液
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.加入无水MgSO4固体,除去有机物中少量的水
d.过滤
e.蒸馏、除去乙醚后,收集151~156℃馏分
①b中水层用乙醚萃取的目的是_____;
②上述操作a、d中使用的玻璃仪器除烧杯、玻璃棒外,还需要的玻璃仪器有____、___,操作a中,加入NaCl固体的作用是_____。
(4)恢复至室温时,分离得到纯产品体积为8mL,则环己酮的产率为____。(保留3位有效数字)