题目内容
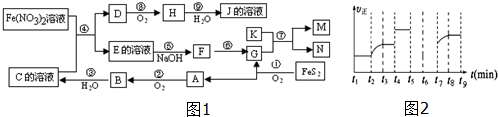
12.有天然透明晶体A是高熔点、高硬度的物质,A在纯氧中不能燃烧,但在高温时既能和石灰石又能和纯碱反应,都放出气体B,A虽不能溶于强碱,却能溶于氢氟酸,并生产气体C,A和烧碱溶液反应生成D的水溶液,将气体B通入该溶液中去,能生成不稳定的白色胶状沉淀E,在干燥空气中,E失去部分水,得到白色粉末F,F加热后再重新生产A.(1)试推断出A、B、C、D、E、F各是什么物质?写出其分子式(或化学式)
A:SiO2 B:CO2 C:SiF4
D:Na2SiO3 E:H4SiO4 F:H2SiO3
(2)写出有关反应的化学方程式:
①SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑ ②SiO2+CaCO3$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑ ③SiO2+4HF═SiF4↑+2H2O ④SiO2+2NaOH=Na2SiO3+H2O
⑤Na2SiO3+CO2+2H2O=Na2CO3+H4SiO4↓ ⑥H4SiO4=H2SiO3+H2O ⑦H2SiO3$\frac{\underline{\;\;△\;\;}}{\;}$SiO2+H2O.
分析 有天然透明晶体A是高熔点、高硬度的物质,A在纯氧中不能燃烧,但在高温时既能和石灰石又能和纯碱反应,都放出气体B,A虽不能溶于强碱,却能溶于氢氟酸,并生产气体C,则A应为SiO2,所以B为CO2,C为SiF4,A和烧碱溶液反应生成D的水溶液,则D为Na2SiO3,将气体B通入该溶液中去,能生成不稳定的白色胶状沉淀E,则E为H4SiO4,在干燥空气中,E失去部分水,得到白色粉末F为H2SiO3,F加热后再重新生产A,符合题中各物质的转化关系,据此答题.
解答 解:有天然透明晶体A是高熔点、高硬度的物质,A在纯氧中不能燃烧,但在高温时既能和石灰石又能和纯碱反应,都放出气体B,A虽不能溶于强碱,却能溶于氢氟酸,并生产气体C,则A应为SiO2,所以B为CO2,C为SiF4,A和烧碱溶液反应生成D的水溶液,则D为Na2SiO3,将气体B通入该溶液中去,能生成不稳定的白色胶状沉淀E,则E为H4SiO4,在干燥空气中,E失去部分水,得到白色粉末F为H2SiO3,F加热后再重新生产A,符合题中各物质的转化关系,
(1)根据上面的分析可知,A为SiO2,B为CO2,C为SiF4,D为Na2SiO3,E为H4SiO4,F为H2SiO3,
故答案为:SiO2;CO2;SiF4;Na2SiO3;H4SiO4;H2SiO3;
(2)在上述过程中的有关反应的化学方程式依次为:①SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑; ②SiO2+CaCO3$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑;③SiO2+4HF═SiF4↑+2H2O; ④SiO2+2NaOH=Na2SiO3+H2O; ⑤Na2SiO3+CO2+2H2O=Na2CO3+H4SiO4↓;⑥H4SiO4=H2SiO3+H2O;⑦H2SiO3$\frac{\underline{\;\;△\;\;}}{\;}$SiO2+H2O,
故答案为::①SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑; ②SiO2+CaCO3$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑;③SiO2+4HF═SiF4↑+2H2O; ④SiO2+2NaOH=Na2SiO3+H2O; ⑤Na2SiO3+CO2+2H2O=Na2CO3+H4SiO4↓;⑥H4SiO4=H2SiO3+H2O;⑦H2SiO3$\frac{\underline{\;\;△\;\;}}{\;}$SiO2+H2O.
点评 本题考查无机物推断、元素化合物性质,主要涉及硅及其化合物的相关知识,重在考查分析能力和综合应用知识的能力,难度不大,注意对基础知识的掌握.

| A. | 甲醛和乙醛 | B. | 丙烯醛和苯甲醛 | C. | 乙酸和甲酸甲酯 | D. | 甲醛和葡萄糖 |
| 实验 金属 | G | L | M | R |
| 和冷水反应 | 无反应 | 慢慢反应 | 未做 | 未做 |
| 和2mol/L HCl 反应 | 溶解并放出气体 | 溶解并放出气体 | 无反应 | 无反应 |
| 和Rn+的水溶液反应 | 溶解并形成沉淀 | 未做 | 溶解并形成沉淀 | 未做 |
| A. | L、G、R、M | B. | G、L、M、R | C. | L、G、M、R | D. | L、R、G、M |
Ⅰ.(1)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H 在0.1MPa时,按n(CO2):n(H2)=1:3投料,图1所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系.
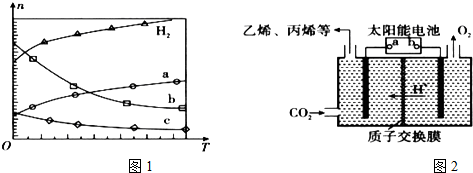
①该反应的△H<0(填“>”、“=”或“<”).
②曲线b表示的物质为H2O.
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是加压(或不断分离出水).
(2)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如图2所示.
b为电源的正极,电解时,生成乙烯的电极反应式是2CO2+12e-+12H+=C2H4+4H2O.
Ⅱ.(3)用活性炭还原法可以处理氮氧化物.如反应:C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ•mol-1.
在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间(min) 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是通入一定量的NO;适当缩小容器的体积;增大压强;通入等物质的量的CO2和N2(答一种即可).
Ⅲ.(4)工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3,其水溶液均呈酸性.相同条件下,同浓度的两种酸式盐的水溶液中c(SO32-)较小的是NH4HSO3,用文字和化学用语解释原因HSO3-?H++SO32-,NH4+水解使c(H+)增大,电离平衡逆向移动,c(SO32-)浓度减小.
| A. | 水沸腾汽化 | |
| B. | 水加热到1500℃开始分解 | |
| C. | 熔融的氯化钠 | |
| D. | 煤矿中瓦斯(主要成分是甲烷)遇火爆炸 |
 ,属于离子化合物.
,属于离子化合物. .
.