题目内容
5.对四种金属G、L、M、R进行如下实验:| 实验 金属 | G | L | M | R |
| 和冷水反应 | 无反应 | 慢慢反应 | 未做 | 未做 |
| 和2mol/L HCl 反应 | 溶解并放出气体 | 溶解并放出气体 | 无反应 | 无反应 |
| 和Rn+的水溶液反应 | 溶解并形成沉淀 | 未做 | 溶解并形成沉淀 | 未做 |
| A. | L、G、R、M | B. | G、L、M、R | C. | L、G、M、R | D. | L、R、G、M |
分析 金属的金属性越强,金属与冷水或酸反应越剧烈,较活泼金属能置换出较不活泼金属,据此判断金属活动性强弱.
解答 解:金属的金属性越强,金属与冷水或酸反应越剧烈,较活泼金属能置换出较不活泼金属,L和冷水反应、G和冷水不反应,说明金属活动性L>G;
G、L和稀盐酸反应生成氢气,M、R和稀盐酸不反应,说明G、L在金属活动性顺序表中位于H之前.M和R位于H元素之后;
M能置换出R单质,说明金属活动性M>R,
通过以上分析知,金属活动性强弱顺序是L>G>M>R,故选C.
点评 本题考查金属活动性强弱判断,可以利用金属与酸或水反应剧烈程度、金属之间的置换反应、金属最高价氧化物的水化物碱性强弱等判断,注意不能根据金属失电子多少判断金属性强弱,为易错点.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
10.下列离子化合物的电子式不正确的是( )
| A. | 氯化钙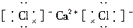 | B. | 硫化钠 | C. | 氮气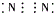 | D. | 二氧化碳 |
17.某元素X气态氢化物与该元素最高价氧化物的水化物反应生成盐,则该元素( )
| A. | 在周期表中处于第三周期ⅦA族 | B. | 在周期表中处于第2周期ⅤA族 | ||
| C. | 氢化物比H2O稳定 | D. | 常见化合价只有-3、+2、+3、+5价 |
15.化学上通常把原子数和电子数相等的分子或离子称为等电子体,人们发现等电子体间的结构和性质相似(即等电子原理),B3N3H6被称为无机苯,它与苯是等电子体,则下列说法中不正确的是( )
| A. | 无机苯分子中只含有极性键 | |
| B. | 无机苯能发生加成反应和取代反应 | |
| C. | 无机苯的二氯取代物有3种同分异构体 | |
| D. | 无机苯不能使KMnO4酸性溶液褪色 |
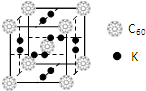 氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.
氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.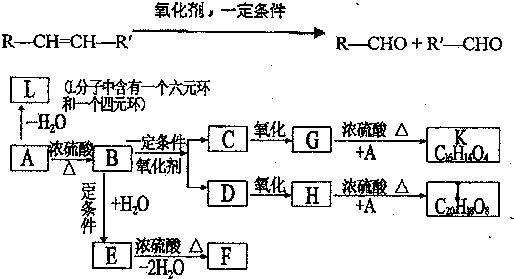
 、K
、K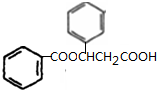 ;
; $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$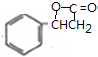 +H2O,反应类型取代反应或酯化反应;
+H2O,反应类型取代反应或酯化反应;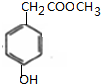 .
.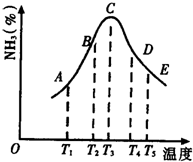 (1)在容积不同的密闭容器内,分别充入同量的N2和H2,在不同温度下,任其发生反应N2+3H2?2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如图:
(1)在容积不同的密闭容器内,分别充入同量的N2和H2,在不同温度下,任其发生反应N2+3H2?2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如图: 某同学在学习了乙醇的知识后,设计了如图所示的实验.操作步骤及观察到的现象如图:
某同学在学习了乙醇的知识后,设计了如图所示的实验.操作步骤及观察到的现象如图: