题目内容
19.恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示.(已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1)请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式S(s)+O2(g)═SO2(g)△H=-297kJ•mol-1.
(2)△H2=-78.64kJ•mol-1.
(3)恒温恒容时,1molSO2和2molO2充分反应,放出热量的数值比|△H2|大(填“大”“小”或“相等”).
(4)恒容条件下,下列措施中能使n(SO3)/n(SO2)增大的有c.
a.升高温度
b.充入He气
c.再充入1molSO2(g)和1molO2(g)
d.使用催化剂
(5)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是升高温度;t1-t2对应的平衡常数为K1,t3-t4对应的平衡常数为K2,t5-t6对应的平衡常数为K3,t6-t7对应的平衡常数为K4,则K1、K2、K3、K4的大小关系为K1=K2>K3=K4.
(6)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.某温度下,2SO2(g)+O2(g)?2SO3(g);△H=mkJ•mol-1,K的大小与温度(T)的关系如图3中曲线所示,b点时v(正)>v(逆)(填“<”、“>”或“=”).反应热(△H)将不变(填“增大”、“减小”或“不变”).
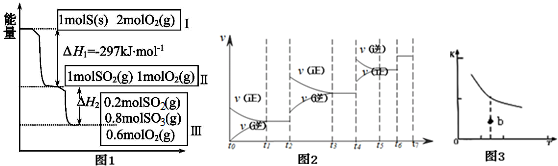
分析 (1)1molS完全燃烧放出297kJ热量,据此书写热化学方程式;
(2)根据2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1知,2mol二氧化硫完全反应生成196.6kJ热量,据此计算(1-0.2)mol=0.8mol二氧化硫完全反应放出的热量;
(3)该反应的正反应是放热反应,恒温恒容时,相当于增大压强,平衡正向移动,二氧化硫转化率增大;
(4)a.该反应的正反应是放热反应,升高温度平衡影响移动;
b.充入He气,二氧化硫、氧气和三氧化硫的浓度不变,平衡不移动;
c.再充入1molSO2(g)和1molO2(g),相当于增大压强,平衡正向移动;
d.使用催化剂平衡不移动;
(5)t4时,正逆反应速率都增大,且逆反应速率增大倍数大于正反应增大倍数,平衡逆向移动;
化学平衡常数只与温度有关,该反应中升高温度平衡常数降低;
(6)该图中曲线为平衡常数与温度之间关系平衡曲线,b点浓度商小于该温度下的K,要使b点达到平衡状态,则平衡正向移动.
解答 解:(1)1molS完全燃烧放出297kJ热量,据此书写热化学方程式为硫的燃烧热的热化学方程式S(s)+O2(g)═SO2(g)△H=-297 kJ•mol-1;
故答案为:S(s)+O2(g)═SO2(g)△H=-297 kJ•mol-1;
(2)由图1可知,参加反应的n(SO2)=1mol-0.2mol=0.8mol,根据热化学方程式:2SO2(g)+O2(g)=2SO3(g)△H=-196.6kJ•mol- 1;可知,△H2=0.4△H=0.4×-196.6kJ•mol- 1=-78.64kJ•mol-1;
故答案为:-78.64kJ•mol-1 ;
(3)恒温恒容时,开始为1molSO2和2molO2 与开始为1molSO2和1molO2 相比,增大氧气的浓度,平衡正向移动,所以开始为1molSO2和2molO2 的SO2转化率高,放出热量的数值比|△H2|大;
故答案为:大;
(4)a、反应为放热反应,温度升高,平衡逆向移动,n(SO3)减小,n(SO2)增大,n(SO3)/n(SO2)减小,故a错误;
b、恒容条件下,充入氦气,反应混合物浓度不变,平衡不移动,n(SO3)/n(SO2)不变,故b错误;
c、再充入1molSO2(g)和1molO2 (g),等效为Ⅱ压强增大一倍,平衡正向移动,n(SO3)/n(SO2)增大,故c正确;
d、使用催化剂,加快反应速率,平衡不移动,n(SO3)/n(SO2)不变,故d错误.
故答案为:c;
(5)t2~t3段正逆速率都加快,且v(正)>v(逆),平衡正向移动.t4~t5段正逆速率都加快,且v(正)<v(逆),平衡逆向移动;该反应为体积减小的放热反应,若升高温度,平衡逆向移动,若增大压强,平衡正向移动,故t2~t3段为增大压强,t4~t5段为升高温度,t6~t7是加入催化剂,平衡常数随温度变化,不随浓度、压强、催化剂等条件改变,反应是放热反应,升温平衡逆向进行,平衡常数减小;平衡常数为K1=K2>K4=K3;
故答案为:升高温度;K1=K2>K3=K4 ;
(6)b点小于平衡状态,若达到平衡状态,平衡正向移动,所以v(正)>v(逆);
反应焓变和起始物质和终了物质能量有关,与变化过程无关,所以温度不变、反应焓变不变;
故答案为:>;不变.
点评 本题考查化学平衡有关计算、外界条件对化学平衡移动影响、热化学方程式的书写等知识点,为高频考点,注意:平衡常数只与温度有关,与物质浓度、压强都无关,易错点是(4)b,只有改变条件能引起反应物或生成物浓度变化时才能使平衡发生移动,题目难度中等.

| A. | 山西王家岭煤矿3•28透水事故被困工作在井下靠吃木屑、树皮,喝凉水维持生命.木屑、树皮的化学成分主要是纤维素 | |
| B. | 乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” | |
| C. |  广为人知的奶粉事件中的罪魁祸首为三聚氰胺(结构如图)其摩尔质量为126g | |
| D. | 2010年4月支援青海玉树地震灾区的生活用品中的食醋、纯碱、食盐,其对应的主要化学物质分别属于酸、碱、盐 |
| A. | 苛性钠Na2CO3 | B. | 胆矾CuSO4 | C. | 苏打NaHCO3 | D. | 火碱NaOH |
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
| A. | 氢氧化钠能与盐酸反应,可用作治疗胃酸过多的药剂 | |
| B. | 氧化铝具有很高的熔点,可制耐高温耐火材料 | |
| C. | 常温下,浓硝酸不跟铁发生化学反应,可用铁制容器盛装浓硝酸 | |
| D. | 钠具有极强的还原性,可用钠与CuCl2溶液反应制取铜 |
 .
. .
. .
. 和
和
 和
和