题目内容
【题目】海洋是巨大的化学资源宝库,人类每年都会从海水中提取很多物质,如图是海水资源综合利用的部分流程。
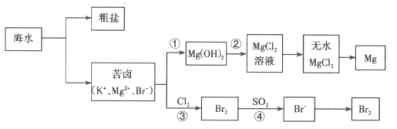
请回答下列问题:
(1)从海水中获取粗盐的方法是___。
(2)步骤①中所加试剂是___,步骤②中发生反应的离子方程式是___。
(3)步骤③中发生反应的离子方程式是___。
(4)步骤④中用“热空气”能从溶液中将Br2吹出的原因是___,用SO2水溶液吸收吹出的Br2时,反应过程中的氧化剂是___。
【答案】蒸发结晶 Ca(OH)2 Mg(OH)2+2H+=Mg2++2H2O Cl2+2Br-=2Cl-+Br2 Br2的挥发性随温度升高而增大 Br2
【解析】
将海水蒸发结晶可到粗盐,得到的苦卤含有钾离子,镁离子,溴离子,经步骤①加入氢氧化钙得到氢氧化镁,氢氧化镁经②加入盐酸得到氯化镁溶液,在充入氯化氢气体的溶液中加热蒸干得到无水氯化镁,电解熔融的氯化镁得到镁单质;步骤③为溴离子被氯气氧化成溴单质,步骤④将溴富集,用“热空气”能从溶液中将Br2吹出,再得到高纯度的溴,据此分析。
(1) 食盐的溶解度受温度影响变化不大,故要从海水中获得粗盐的结晶方法是蒸发结晶;
(2)根据分析可知,步骤①中所加试剂是氢氧化钙,将镁离子转化为氢氧化镁,步骤②是氢氧化镁和盐酸反应制得氯化镁的过程,发生反应的离子方程式是:Mg(OH)2+2H+=Mg2++2H2O;
(3)步骤③发生氯气与溴离子的反应,发生反应的离子方程式是:Cl2+2Br-=2Cl-+Br2;
(4)步骤④中用“热空气”能从溶液中将Br2吹出的原因是Br2的挥发性随温度升高而增大,用SO2水溶液吸收吹出的Br2时,溴和二氧化硫和水反应生成氢溴酸和硫酸,溴单质的化合价降低,故氧化剂是Br2。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目