题目内容
【题目】氨是最重要的化工原料之一,自20世纪初以来,工业上合成氨主要依赖Haber-Bosch技术。探索新的合成氨的方法一直是重要课题。
(1)最新的“人工固氮”研究报道:在常温、常压、光照条件下,N2在催化剂表面与水发生反应,直接生成氨气和氧气。
已知:N2(g) + 3H2(g)![]() 2NH3(g)
2NH3(g) ![]() H = -a kJ/mol
H = -a kJ/mol
2H2(g) + O2(g) = 2H2O(1) ![]() H = -b kJ/mol
H = -b kJ/mol
写出上述固氮反应的热化学方程式:_______________。
(2)恒温、恒容条件下,在容器中模拟Haber-Bosch法合成氨,如下图(图中所示数据为初始物理量)。t分钟后反应达到平衡,生成的NH3为0.4 mol。
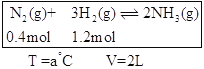
①判断该容器中的反应达平衡的依据是_______(填字母)。
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(N2)不随时间改变
d.单位时间内生成2 mol NH3的同时消耗1 mol N2
e.单位时间内断裂3 mol H-H键,同时断裂6 mol N-H键
②该条件下容器中反应的平衡常数K=___;平衡时,混合气体压强p平=____(用初始压强p0表示)。
(3)近期,两位希腊化学家提出了电解合成氨的新思路:采用高质子导电性的SCY陶瓷(能传递H+)为介质,实现了高温(570℃)常压下高转化率的电解法合成氨,转化率可达到78%,装置如图:
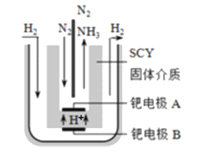
钯电极A是电解池的_____极(填“阳”或“阴”),阴极反应式为________________________________。
(4)合成氨需要纯净的氮气和氢气,在制取原料气的过程中,常混有一些杂质,其中的某些杂质会使合成氨的催化剂“中毒”,所以必须除去。例如,用稀氨水吸收H2S杂质:NH3·H2O + H2S![]()
![]() +HS-+ H2O,若将标况下22.4L H2S通入1L 1mol/L NH3·H2O中进行吸收,则达到平衡时,H2S的吸收效率为_________%(结果保留两位有效数字)。(注:吸收效率=c(H2S)已反应/c(H2S)总)(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2S的电离平衡常数Ka1 = 5×10-8,Ka2 = 7.1×10-15)
+HS-+ H2O,若将标况下22.4L H2S通入1L 1mol/L NH3·H2O中进行吸收,则达到平衡时,H2S的吸收效率为_________%(结果保留两位有效数字)。(注:吸收效率=c(H2S)已反应/c(H2S)总)(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2S的电离平衡常数Ka1 = 5×10-8,Ka2 = 7.1×10-15)
【答案】2N2(g)+6H2O(l) = 4NH3(g) + 3O2(g) ![]() H= (3b-2a) kJ/mol ace
H= (3b-2a) kJ/mol ace ![]() (或14.8)
(或14.8) ![]() P0 阴 N2 + 6e- + 6H+ = 2NH3 91
P0 阴 N2 + 6e- + 6H+ = 2NH3 91
【解析】
(1)根据盖斯定律分析解答;
(2)①根据可逆反应到达平衡时,正、逆速率相等,各组分的浓度、含量保持不变分析判断;②根据三段式列式计算;
(3)电解池中,阳离子移向阴极,在阴极上发生还原反应;
(4)首先计算NH3·H2O + H2S![]()
![]() +HS-+ H2O的平衡常数,再假设反应的H2S为物质的量浓度为x,根据平衡常数列式计算。
+HS-+ H2O的平衡常数,再假设反应的H2S为物质的量浓度为x,根据平衡常数列式计算。
(1)①N2(g)+3H2(g)=2NH3(g) △H=-a kJ/mol,②O2(g)+2H2(g)═2H2O(l) △H=-b kJ/mol,根据盖斯定律,将①×2-②×3得到反应2N2(g)+6H2O(l)═4NH3(g)+3O2(g)△H=(3b-2a)kJ/mol,故答案为:2N2(g)+6H2O(I)=4NH3(g)+3O2(g)△H=(3b-2a)kJ/mol;
(2)①a.该反应反应后气体物质的量减小,恒温恒容下容器内压强减小,当压强不随时间改变,说明到达平衡状态,故a正确;b.混合气体总质量不变,容器容积不变,混合气体的密度始终不变,混合气体的密度不变,不能说明到达平衡状态,故b错误;c.到达平衡时各组分浓度保持不变,c(N2)不随时间改变,说明到达化学平衡状态,故c正确;d.单位时间内生成2molNH3的同时消耗1molN2,均表示正反应速率,反应始终按该比例关系进行,不能说明到达平衡状态,故d错误;e.单位时间内断裂3molH-H键,同时断裂6molN-H键,而断裂6molN-H键会生成3molH-H键,氢气的生成速率与消耗速率相等,说明反应到达平衡,故e正确,故选:ace;
②甲容器t分钟后反应均达到平衡,生成的NH3均为0.4mol,则:
N2(g)+3H2(g)2NH3(g)
起始量(mol):0.4 1.2 0
变化量(mol):0.2 0.6 0.4
平衡量(mol):0.2 0.6 0.4
则平衡常数K=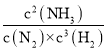 =
=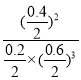 =
=![]() ;恒温恒容下压强之比等于气体物质的量之比,则平衡时,甲的压强P平=
;恒温恒容下压强之比等于气体物质的量之比,则平衡时,甲的压强P平=![]() P0=
P0=![]() P0,故答案为:
P0,故答案为:![]() ;
;![]() P0;
P0;
(3)电解池中,氢离子移向阴极,所以钯电极A是电解池的阴极,阴极发生还原反应,氮气在阴极上放电,与氢离子结合生成氨气,即N2+6e-+6H+=2NH3,阳极反应式为:H2-2e-=2H+,故答案为:阴;N2+6e-+6H+=2NH3;
(4)标况下22.4L H2S的物质的量=![]() =1mol,1L 1mol/L NH3·H2O中含有1molNH3·H2O,NH3·H2O + H2S
=1mol,1L 1mol/L NH3·H2O中含有1molNH3·H2O,NH3·H2O + H2S![]()
![]() +HS-+ H2O的平衡常数K=
+HS-+ H2O的平衡常数K=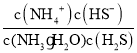 =
=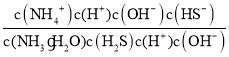 =
=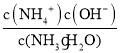 ×
×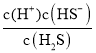 ×
×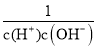 =Kb×Ka1×
=Kb×Ka1×![]() =2×10-5×5×10-8×
=2×10-5×5×10-8×![]() =100,设反应的H2S为物质的量浓度为x,因此100=
=100,设反应的H2S为物质的量浓度为x,因此100=![]() ,解得x=
,解得x=![]() mol/L,则吸收效率=
mol/L,则吸收效率= ×100%=
×100%=![]() ×100%=91%,故答案为:91。
×100%=91%,故答案为:91。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案