题目内容
20.下列反应过程中能量变化符合如图所示的是( )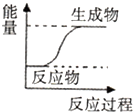
| A. | C+C02 $\frac{\underline{\;高温\;}}{\;}$2CO | B. | Zn+H2S04=ZnS04+H2↑ | ||
| C. | CH4+202$\stackrel{点燃}{→}$C02+2H20 | D. | K0H+HN03=KN03+H20 |
分析 生成物具有的总能量高于反应物具有的总能量,该反应为吸热反应.
①放热反应:有热量放出的化学反应,因为反应物具有的总能量高于生成物具有的总能量.常见放热反应:燃烧与缓慢氧化,中和反应;金属与酸反应制取氢气,生石灰和水反应等.
②吸热反应:有热量吸收的化学反应,因为反应物具有的总能量低于生成物具有的总能量.常见的吸热反应:C(s)+H2O(g)→CO(g)+H2O; C+CO2→CO的反应,以及KClO3、KMnO4、CaCO3的分解等
解答 解:A.碳与二氧化碳的反应是吸热反应,故A正确;
B.活泼金属与酸反应是放热反应,故B错误;
C.燃烧反应是放热反应,故C错误;
D.酸碱中和反应是放热反应,故D错误.
故选A.
点评 本题考查化学反应的热量变化,学生应注重归纳中学化学中常见的吸热或放热的反应,对于特殊过程中的热量变化的要熟练记忆来解答此类习题.

练习册系列答案
相关题目
11. 对硫-氮化合物的研究是现代无机化学最为活跃的领域之一,如图是已经合成的最著名的硫-氮化合物的分子结构.下列关于该物质说法正确的是( )
对硫-氮化合物的研究是现代无机化学最为活跃的领域之一,如图是已经合成的最著名的硫-氮化合物的分子结构.下列关于该物质说法正确的是( )
 对硫-氮化合物的研究是现代无机化学最为活跃的领域之一,如图是已经合成的最著名的硫-氮化合物的分子结构.下列关于该物质说法正确的是( )
对硫-氮化合物的研究是现代无机化学最为活跃的领域之一,如图是已经合成的最著名的硫-氮化合物的分子结构.下列关于该物质说法正确的是( )| A. | 分子式为SN | |
| B. | 分子中既有极性键又有非极性键 | |
| C. | 分子中所有共价键的键长一定相等 | |
| D. | 该物质与化合物S2N2互为同素异形体 |
8.关于下列实验装置及用途的叙述不正确的是( )
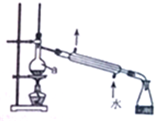

| A. | 仪器a为圆底烧瓶 | B. | 可用于实验室蒸馏石油 | ||
| C. | 可用于分离苯和溴苯的混合物 | D. | 可用于分离乙酸和乙醇的混合物 |
15.记录片《穹顶之下》再次引起人们对大气质量的强烈关注,化石能源的大量使用是造成大气污染 的主要原因.下列不属于化石能源的是( )
| A. | 煤 | B. | 石油 | C. | 天然气 | D. | 生物质能 |
5.下列说法中错误的是( )
①化学性质相似的有机物是同系物
②分子组成相差一个或几个CH4原子团的有机物是同系物
③若烃中碳、氢元素的质量分数相同,它们必定是同系物
④互为同分异构体的两种有机物的物理性质有差别,但化学性质必定相似.
①化学性质相似的有机物是同系物
②分子组成相差一个或几个CH4原子团的有机物是同系物
③若烃中碳、氢元素的质量分数相同,它们必定是同系物
④互为同分异构体的两种有机物的物理性质有差别,但化学性质必定相似.
| A. | ①②③④ | B. | 只有②③ | C. | 只有③④ | D. | 只有①②③ |
12.(1)现有分子式均为C3H6O2的四种有机物A、B、C、D,且分子中均含甲基,把它们分别进行下列实验加以鉴别,实验记录如下:
则A、B、C、D的结构简式分别为:ACH3CH2COOH;BCH3CH(OH)CHO;CHCOOCH2CH3;DCH3COOCH3.
(2)已知葡萄糖在乳酸菌作用下可转化为乳酸(C3H6O3),取9g乳酸与足量金属Na反应,可生成2.24LH2(标准状况),另取同量乳酸与同物质的量的乙醇反应,生成0.1mol乳酸乙脂和1.8g水;乳酸在Cu作催化剂时可被氧化成丙酮酸(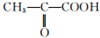 ),由以上事实推知乳酸的结构简式为CH3CH(OH)COOH.
),由以上事实推知乳酸的结构简式为CH3CH(OH)COOH.
(3)两个乳酸分子在一定条件下脱水生成环酯(C6H8O4),则此环酯的结构简式是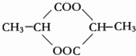 .
.
| NaOH溶液 | 银氨溶液 | 新制Cu(OH)2悬浊液 | 金属钠 | |
| A | 中和反应 | - | 溶解 | 产生氢气 |
| B | - | 有银镜 | 加热后有砖红色沉淀 | 产生氢气 |
| C | 水解反应 | 有银镜 | 加热后有砖红色沉淀 | - |
| D | 水解反应 | - | - | - |
(2)已知葡萄糖在乳酸菌作用下可转化为乳酸(C3H6O3),取9g乳酸与足量金属Na反应,可生成2.24LH2(标准状况),另取同量乳酸与同物质的量的乙醇反应,生成0.1mol乳酸乙脂和1.8g水;乳酸在Cu作催化剂时可被氧化成丙酮酸(
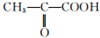 ),由以上事实推知乳酸的结构简式为CH3CH(OH)COOH.
),由以上事实推知乳酸的结构简式为CH3CH(OH)COOH.(3)两个乳酸分子在一定条件下脱水生成环酯(C6H8O4),则此环酯的结构简式是
 .
.
9.从金属利用的历史来看,先是青铜器时代,而后是铁器时代,铝的利用是近百年的事.这个先后顺序跟下列有关的是:①地壳中的金属元素的含量;②金属活动性;③金属的导电性;④金属冶炼的难易程度;⑤金属的延展性( )
| A. | ①③ | B. | ②④ | C. | ③⑤ | D. | ②⑤ |
10.设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 1.7g OH- 所含电子数为0.9NA | |
| B. | 标准状况下,11.2 L HCl 所含质子数为18NA | |
| C. | 7.8gNa2O2固体中含有的离子数为4NA | |
| D. | 0.5 mol D2O 中所含质子数为5NA |
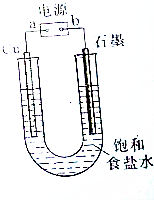 用如图所示装置电解饱和食盐水制Cl2、H2和NaOH.
用如图所示装置电解饱和食盐水制Cl2、H2和NaOH.