题目内容
15.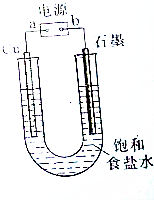 用如图所示装置电解饱和食盐水制Cl2、H2和NaOH.
用如图所示装置电解饱和食盐水制Cl2、H2和NaOH.(1)a为电源的负极,阳极的电极反应式为2Cl--2e-=Cl2↑;
(2)某同学在进行上述实验时,发现铜电极下方产生红色沉淀,石墨电极上产生无色无味的气体,则该同学将石墨连接到了电源的负极.经检验红色沉淀为Cu2O,则此时阳极的电极反应式是2OH-+2Cu-2e-=Cu2O↓+H2O;
(3)若电源是N2H4、O2、KOH溶液和多孔铂电极构成的原电池,则负极反应时为N2H4+4OH--4e-=N2+4H2O,正极反应式为O2+2H2O+4e-=4OH-.
分析 (1)用惰性电极电解饱和食盐水时,在阳极上产生氯气,在阴极上产生氢气和氢氧化钠;
(2)铜电极下方产生红色沉淀,石墨电极上产生无色无味的气体,则金属铜是阳极,石墨是阴极,根据电解池的工作原理以及电极反应式的书写方法来回答判断;
(3)燃料电池中,负极上燃料N2H4失电子发生氧化反应,正极上氧化剂O2得电子发生还原反应.
解答 解:(1)用惰性电极电解饱和食盐水时,在阳极上产生氯气,在阴极上产生氢气和氢氧化钠,此时阳极是惰性电极,即a为电源的负极,阳极的电极反应式为:2Cl--2e-=Cl2↑,故答案为:2Cl--2e-=Cl2↑;
(2)发现铜电极下方产生红色沉淀,则金属铜是阳极,a为电源的正极,石墨连接到了电源的负极,阳极的电极反应式为:2OH-+2Cu-2e-=Cu2O↓+H2O,故答案为:2OH-+2Cu-2e-=Cu2O↓+H2O;
(3)作为燃料电池时,负极发生氧化反应,电解质溶液是KOH溶液,N2H4失去电子被氧化生成N2,电极反应式为N2H4+4OH--4e-=N2+4H2O,正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,故答案为:N2H4+4OH--4e-=N2+4H2O;O2+2H2O+4e-=4OH-.
点评 本题考查了电解原理,明确离子放电顺序是解本题关键,知道没有交换膜时,阴极区域发生的反应,题目难度不大.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
8.有机物甲的分子式为CxHyO2,其中氧的质量分数为20.25%,碳的质量分数为68.35%.在酸性条件下,甲水解生成乙和丙两种有机物;在相同温度和压强下,同质量的乙和丙的蒸气所占的体积相同,则甲的结构可能有( )
| A. | 8种 | B. | 14种 | C. | 16种 | D. | 18种 |
8.下列说法正确的是( )


| A. | 在常温下,0.10mol•L-1Na2CO3溶液25mL 用0.10mol•L-1盐酸滴定.当滴定到消耗20mlHCl时所得溶液中离子浓度间的关系有:5c(Cl-)═4c(HCO3-)+4c(CO32-)+4c(H2CO3) | |
| B. | 常温下物质的量浓度相等的①(NH4)2CO3 ②(NH4)2SO4③(NH4)2Fe(SO4)2三种溶液中水的电离程度:③>①>② | |
| C. | 常温下醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示,当pH=4.5溶液中:C(CH3COO-)>C(CH3COOH)>C(H+)>C(OH-) | |
| D. | 等体积等物质的量浓度的NaF溶液与NaCl溶液中离子总数:N(NaF)>N(NaCl) |
10.下列关于煤、石油及其所得产品的叙述正确的是( )
| A. | 煤和石油都是混合物,均由碳和氢两种元素组成 | |
| B. | 液化石油气和天然气的主要成分都是甲烷 | |
| C. | 煤的干馏和石油的分馏发生的都是化学变化 | |
| D. | 用溴的四氯化碳溶液可鉴别分馏获得的汽油和裂化获得的汽油 |
7.已知某饱和一元醇分子中含m个-CH2-,n个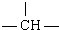 一个-OH,其余为甲基,则甲基个数为( )
一个-OH,其余为甲基,则甲基个数为( )
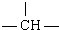 一个-OH,其余为甲基,则甲基个数为( )
一个-OH,其余为甲基,则甲基个数为( )| A. | 2n+3m-1 | B. | m+n-1 | C. | n+2m+1 | D. | n+1 |
20.下列反应过程中能量变化符合如图所示的是( )
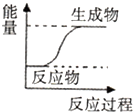

| A. | C+C02 $\frac{\underline{\;高温\;}}{\;}$2CO | B. | Zn+H2S04=ZnS04+H2↑ | ||
| C. | CH4+202$\stackrel{点燃}{→}$C02+2H20 | D. | K0H+HN03=KN03+H20 |

