题目内容
15.氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3.请回答下列问题:(1)Na3N的电子式是
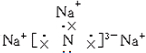 ,该化合物由离子键形成.
,该化合物由离子键形成.(2)Na3N与盐酸反应生成2种盐,其电子式分别是
 ,
, .
.(3)Na3N与水的反应属于复分解(填基本反应类型)反应.
(4)比较Na3N中两种粒子的半径:r(Na+)< (填“>”“=”“<”) r(N3-).
分析 (1)氮化钠是由钠离子与氮离子通过离子键结合成的离子化合物;
(2)Na3N与盐酸反应生成氯化钠和氯化铵,氯化钠是由钠离子与氯离子通过离子键结合生成离子化合物,氯化铵是由氨根离子与氯离子通过离子键结合形成离子化合物;
(3)根据原子守恒,判断出氮化钠与与水反应产物,判断反应类型;
(4)具有相同核外电子排布的,质子数越大,半径越小.
解答 解:(1)氮化钠是由钠离子与氮离子通过离子键结合成的离子化合物,电子式为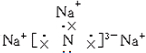 ,故答案为:
,故答案为: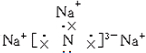 ;离子;
;离子;
(2)Na3N与盐酸反应生成氯化钠和氯化铵,方程式Na3N+4HCl=3NaCl+NH4Cl,氯化钠为离子化合物,电子式为: ;氯化铵为离子化合物,电子式:
;氯化铵为离子化合物,电子式: ;
;
故答案为:2; ;
; ;
;
(3)Na3N电离出Na+、N3-,H2O电离出H+、OH-,N3-和H+结合成为NH3,Na+与OH-结合成为NaOH,氮化钠和水发生了复分解反应,反应的方程式是:Na3N+3H2O=3NaOH+NH3↑,
故答案为:复分解;
(4)钠离子与氮离子具有相同的核外电子排布,钠离子质子数多与氮离子,所以钠离子半径小于氮离子,故答案为:<.
点评 本题考查化学键的有关判断、电子式的书写及化学反应类型判断,明确氮化钠的结构是解题关键,注意掌握电子式的书写方法,题目难度不大.

练习册系列答案
相关题目
3.今有A、B两种原子,A原子的M层比B原子的M层少2个电子,B原子的L层电子数为A原子L层电子数的2倍.A和B分别是( )
| A. | C和Mg | B. | Si和Na | C. | Cl和C | D. | B和He |
10.为提纯下表所列有机物(括号内为所含的少量杂质),从(Ⅰ)中选择适宜的试剂,从(Ⅱ)中选择最佳提纯的方法,将序号填入表中.
(Ⅰ)试剂:a.浓硫酸 b.氢氧化钠 c.生石灰 d.碳酸钠 e.水 f.浓溴水
(Ⅱ)方法:A.过滤 B.分液 C.蒸馏 D.蒸发
(3)在B的操作中,使用的主要玻璃仪器是(梨形)分液漏斗.
(Ⅰ)试剂:a.浓硫酸 b.氢氧化钠 c.生石灰 d.碳酸钠 e.水 f.浓溴水
(Ⅱ)方法:A.过滤 B.分液 C.蒸馏 D.蒸发
| 要提纯的物质 (少量杂质) | 溴乙烷 (乙醇) | 乙醇 (水) | 乙酸乙酯 (乙酸) | 苯 (苯酚) |
| (1)选用试剂 | ||||
| (2)分离方法 |
20.回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol(中和热数值为57.3kJ/mol).
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).实验中测得起始温度与终止温度的平均温差为4.0℃则中和热△H=-53.5kJ/mol(取小数点后一位).用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会偏小.(填“偏大”、“偏小”、“无影响”)
(3)X、R是短周期主族元素,X、R在周期表中的相对位置如表所示;X元素最低负化合价的绝对值等于其原子的最外层电子数; 已知由X和R形成的液态化合物XR2的燃烧热是1075kJ/mol,试写出表示其燃烧热的热化学方程式CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ/mol.写出化合物XR2的结构式S=C=S.
(4)白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10.已知298K时白磷、红磷完全燃烧的热化学方程式分别为P4(s,白磷)+5O2(g)═P4O10(s)△H1=-2 983.2kJ•mol-1.在298K时白磷不完全燃烧的热化学方程式为P4(s,白磷)+3O2(g)═P4O6(s)△H=-1638kJ•mol-1.在某密闭容器中加入62g白磷和50.4L氧气(标准状况),控制条件使之恰好完全反应.则所得到的P4O10与P4O6的物质的量之比为3:1,反应过程中放出的热量为1323.45 kJ.
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol(中和热数值为57.3kJ/mol).
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).实验中测得起始温度与终止温度的平均温差为4.0℃则中和热△H=-53.5kJ/mol(取小数点后一位).用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会偏小.(填“偏大”、“偏小”、“无影响”)
(3)X、R是短周期主族元素,X、R在周期表中的相对位置如表所示;X元素最低负化合价的绝对值等于其原子的最外层电子数; 已知由X和R形成的液态化合物XR2的燃烧热是1075kJ/mol,试写出表示其燃烧热的热化学方程式CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ/mol.写出化合物XR2的结构式S=C=S.
| X | ||||
| R |
7.已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
| A. | 第一电离能:Y可能大于或小于X | |
| B. | 气态氢化物的稳定性:HmY强于HnX | |
| C. | 最高价含氧酸的酸性X强于Y | |
| D. | X和Y形成化合物时,X显负价Y显正价 |
 ;
;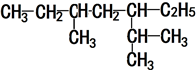 的系统命名为2,5-二甲基-3-乙基庚烷.
的系统命名为2,5-二甲基-3-乙基庚烷. .
. .
.