题目内容
12.下列有关叙述正确的是( )| A. | 氢键是一种特殊化学键,它广泛地存在于自然界中 | |
| B. | 在 分子中含有1个手性C原子 分子中含有1个手性C原子 | |
| C. | 碘单质在水溶液中溶解度很小是因为I2和H2O都是非极性分子 | |
| D. | 含氧酸可用通式XOm(OH)n来表示,若n值越大,则含氧酸的酸性越强 |
分析 A、氢键是一种分子间作用力,不是化学键;
B、一个碳原子与其它四个不同的原子或原子团相连的碳为手性C原子;
C、I2和是非极性分子而H2O是极性分子,非极性分子难溶于极性溶剂;
D、含氧酸可用通式XOm(OH)n来表示,式中m大于等于2的是强酸,m为0的是弱酸,据此可知,非羟基氧原子数目越大,酸性越强.
解答 解:A、氢键是一种分子间作用力,不是化学键,故A错误;
B、一个碳原子与其它四个不同的原子或原子团相连的碳为手性C原子,中间的碳为手性C原子,故B正确;
C、I2和是非极性分子而H2O是极性分子,非极性分子难溶于极性溶剂,相似相溶的所以碘单质在水溶液中溶解度很小,故C错误;
D、含氧酸可用通式XOm(OH)n来表示,式中m大于等于2的是强酸,m为0的是弱酸,据此可知,非羟基氧原子数目越大,酸性越强,故D错误;
故选B.
点评 本题考查分子间作用力和分子的极性、手性C原子,根据非羟基氧原子数目多少来确定酸性强弱即可,难度不大.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
2.对某一可逆反应来说,使用催化剂的作用是( )
| A. | 改变平衡混合物的组成 | B. | 提高反应物的平衡转化率 | ||
| C. | 以同样程度改变正逆反应速率 | D. | 增大正反应速率,降低逆反应速率 |
3.已知某粒子ZARn+,则元素ZARn+的电子数是( )
| A. | Z | B. | A-Z | C. | Z-n | D. | Z+n |
20.下列物质中,只含有共价键,不含有离子键的是( )
| A. | Na2O2 | B. | KOH | C. | CaCl2 | D. | CO2 |
7.如图为碱性氢氧燃料电池原理示意图,按照此图的提示,下列叙述正确的是( )
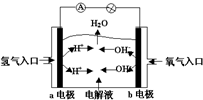

| A. | a电极是负极,电极反应为:H2-2e-═2H+ | |
| B. | b电极是正极,电极反应为:4OH-+4e-═2H2O+O2↑ | |
| C. | 电子从a极流向电流表、小灯泡、b极、通过电解质溶液形成闭合回路 | |
| D. | 电解质溶液中OH-向a极移动 |
17.下列叙述正确的是( )
| A. | 离子键只有饱和性没有方向性 | B. | 离子晶体中只含有离子键 | ||
| C. | 离子键的强弱可用晶格能来衡量 | D. | 离子键的强弱可用原子化热来衡量 |
4.下列水解的离子方程式正确的是( )
| A. | S2-+2H2O?H2S+2OH- | B. | CH3COO-+H2O?CH3COOH+OH- | ||
| C. | CH3COOH+H2O?CH3COO-+H3O+ | D. | Fe3++3H2O?Fe(OH)3↓+3H+ |
1.下列说法不正确的是( )
| A. | 在电解池中阴离子向阳极移动;在原电池中阴离子向正极移动 | |
| B. | 在电解池中,阳极发生氧化反应,在原电池中,负极发生氧化反应 | |
| C. | 电解池的阳极与电源的正极相连 | |
| D. | 电解过程中,电子从电源的负极流出到达阴极,从阳极流出回到电源的正极 |
2.下列解释过程或事实的方程式不正确的是( )
| A. | 熔融烧碱时,不能使用普通石英坩埚:SiO2+2NaOH$\frac{\underline{\;\;△\;\;}}{\;}$Na2SiO3+H2O | |
| B. | 向Na2SO3、NaI的混合溶液中滴加少量氯水:2I-+C12═2 Cl-+I2 | |
| C. | 红热的铁丝与水接触,表面形成蓝黑色(或黑色)保护层:3Fe+4H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2 | |
| D. | “84消毒液”(有效成分NaClO)和“洁厕灵”(主要成分HCl)混合使用放出氯气:ClO-+Cl-+2H+═Cl2↑+H2O |