题目内容
16.下列说法正确的是( )| A. | 由于水中存在氢键,所以水很稳定 | |
| B. | 能与酸反应生成盐和水的氧化物一定是碱性氧化物 | |
| C. | Na2O2中既含有离子键,又含有非极性键 | |
| D. | 由于C═O键是极性键,所以CO2是极性分子 |
分析 A、氢键只影响物理性质,与物质稳定性无关;
B、能与酸反应的氧化物不一定就是碱性氧化物,如三氧化二铝与酸反应生成盐和水,但是两性氧化物;
C、Na2O2中既含有钠离子与过氧根离子之间形成的离子键,又含有氧氧非极性键;
D、CO2分子是直线型,正负电荷中心重合.
解答 解:A、氢键只影响物理性质,与物质稳定性无关,水分子稳定性与分子中共价键的强弱有关,故A错误;
B、能与酸反应的氧化物不一定就是碱性氧化物,如三氧化二铝与酸反应生成盐和水,但是两性氧化物,故B错误;
C、Na2O2中既含有钠离子与过氧根离子之间形成的离子键,又含有氧氧非极性键,故C正确;
D、CO2分子是直线型,正负电荷中心重合,所以二氧化碳是极性键形成的非极性分子,故D错误;
故选C.
点评 本题考查物质结构与性质知识,难度不大,注意CO2分子的价层电子对是2,根据价层电子对互斥理论,CO2分子极性键形成的直线型分子.

练习册系列答案
相关题目
11.下列有关丙烷的叙述不正确的是( )
| A. | 是直链烃,但分子中碳原子不在一条直线上 | |
| B. | 在光照条件下能够与氯气发生取代反应 | |
| C. | 丙烷比其同分异构体丁烷易汽化,耗氧量少 | |
| D. | 燃烧时主要是将化学能转变为热能和光能 |
12.近来查明,二氧化三碳(C3O2)是金星大气层的一个组成部分,且其分子中所有原子最外层均达到8电子稳定结构.下列关于二氧化三碳的说法错误的是( )
| A. | 二氧化三碳的电子式为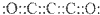 | B. | C3O2、CO、CO2都是碳的氧化物 | ||
| C. | C3O2和CO一样可以燃烧生成CO2 | D. | C3O2和CO2都是碳酸的酸酐 |
4.2006年诺贝尔化学奖授予美国科学家Roger.D.Kormberg,他揭示了真核生物体内细胞如何利用基因内存储的信息合成蛋白质.下列关于蛋白质和氨基酸的说法正确的是( )
| A. | 可以采用多次盐析和溶解的方法分离提纯蛋白质 | |
| B. | HCHO溶液或(NH4)2SO4溶液均能使蛋白质变性 | |
| C. | 肽键是蛋白质二级结构中的主键 | |
| D. | 用甘氨酸和丙氨酸缩合最多可以形成3种二肽 |
11.下列叙述正确的是( )
| A. | 糖类、油脂、蛋白质和DNA都是提供人体能量的重要物质基础 | |
| B. | 塑料管材、奶瓶、食物保鲜膜、大棚塑料薄膜等主要材料是聚氯乙烯 | |
| C. | SO2、NO2、NO、氟氯烃、CO2等均是造成大气污染的重要物质 | |
| D. | 氢键、分子间作用力、离子键和共价键均为微粒间的相互作用力 |
1.气态烃A100mL,最多可与200mLHCl气体发生加成反应生成B,1molB最多可与4mol氯气发生取代反应,则A为( )
| A. | CH2=CH2 | B. | CH≡CH | C. | CH2=CHCH3 | D. | CH3C≡CH |
8.已知298K,1.01×105Pa条件下:2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-282.9kJ•mol-1下列热化学方程式正确的是( )
| A. | CO(g)+H2O(g)=H2(g)+CO2(g)△H=-41.1kJ•mol-1 | |
| B. | CO(g)+H2O(g)=H2(g)+CO2(g)△H=+200.7kJ•mol-1 | |
| C. | CO(g)+H2O(g)=H2(g)+CO2(g)△H=-766.5kJ•mol-1 | |
| D. | CO(g)+H2O(g)=H2(g)+CO2(g)△H=+41.1kJ•mol-1 |
5.下列有关溶液组成的描述合理的是( )
| A. | 无色透明的溶液中:HCO3-、K+、Na+、MnO4- | |
| B. | 酸性溶液中可能大量存在Na+、ClO-、SO42-、I- | |
| C. | 含有0.1 mol•L-1 Fe3+的溶液中可以大量存在:K+、Mg2+、I-、NO3- | |
| D. | 室温下,pH=l的溶液中一定可以存在:Na+、Fe3+、NO3-、SO42- |