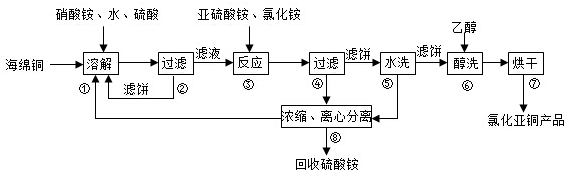
题目内容
12.近来查明,二氧化三碳(C3O2)是金星大气层的一个组成部分,且其分子中所有原子最外层均达到8电子稳定结构.下列关于二氧化三碳的说法错误的是( )| A. | 二氧化三碳的电子式为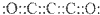 | B. | C3O2、CO、CO2都是碳的氧化物 | ||
| C. | C3O2和CO一样可以燃烧生成CO2 | D. | C3O2和CO2都是碳酸的酸酐 |
分析 A、二氧化三碳中所有原子最外层均达到8电子稳定结构,则其结构式为:O=C=C=C=O;
B、氧化物是由两种元素构成,其中一种是氧元素的化合物;
C、根据C3O2和CO中碳元素的化合价分析;
D、碳酸中碳元素的化合价为+4价,根据碳元素的化合价分析.
解答 解:A、二氧化三碳中所有原子最外层均达到8电子稳定结构,则其结构式为:O=C=C=C=O,其电子式为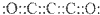 ,故A正确;
,故A正确;
B、氧化物是由两种元素构成,其中一种是氧元素的化合物,所以C3O2、CO、CO2都是碳的氧化物,故B正确;
C、C3O2中碳元素的化合价为+3价和CO中碳元素的化合价为+2价,碳元素充分燃烧的产物是二氧化碳,其中碳元素的化合价为+4价,所以C3O2和CO一样可以燃烧生成CO2,故C正确;
D、碳酸中碳元素的化合价为+4价,其酸酐为二氧化碳,而C3O2中碳元素的化合价为+3价,所以它不是碳酸的酸酐,故D错误;
故选D.
点评 本题考查了碳的氧化物,主要考查了电子式、氧化物的概念、酸酐等,难度中等,注意把握电子式的书写方法.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
2.某课外兴趣小组对H2O2的分解速率做了如下实验探究:
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:用l0mL H2O2制取150mL O2所需的时问(s)
①验证影响反应速率的因素时要考试控制变量.取相同浓度的H2O2进行实验,上表反应条件中考虑控制单因子变量的是温度、浓度、催化剂.
②对照反应条件a和b,可以说明催化剂 因素对过氧化氢分解的速率有影响,该影响可具体表述为催化剂加快分解速率.
(2)将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木条测试.测试结果加下.
①写出加入MnO2后H2O2发生反应的化学方程式2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
②上述实验中,使用粉末状催化剂和块状催化剂所得过氧化氢分解反应的反应速率之比为10:1.
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:用l0mL H2O2制取150mL O2所需的时问(s)
| 浓度 时间(s) 反应条件 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热(t1℃) | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热(t2℃) | 360(a) | 480 | 540 | 720 |
| MnO2催化剂、加热(t2℃) | 10(b) | 25 | 60 | 120 |
②对照反应条件a和b,可以说明催化剂 因素对过氧化氢分解的速率有影响,该影响可具体表述为催化剂加快分解速率.
(2)将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木条测试.测试结果加下.
| 催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3min |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30min |
②上述实验中,使用粉末状催化剂和块状催化剂所得过氧化氢分解反应的反应速率之比为10:1.
17.某羧酸酯的分子式为C18H26O5,1mol该酯完全水解可得到1mol羧酸和2mol乙醇,该羧酸的分子式为( )
| A. | C14H18O5 | B. | C14H16O4 | C. | C16H22O5 | D. | C16H20O5 |
16.下列说法正确的是( )
| A. | 由于水中存在氢键,所以水很稳定 | |
| B. | 能与酸反应生成盐和水的氧化物一定是碱性氧化物 | |
| C. | Na2O2中既含有离子键,又含有非极性键 | |
| D. | 由于C═O键是极性键,所以CO2是极性分子 |
17.某溶液100mL,室温时测得其pH等于1,下列叙述中不正确的是( )
| A. | 该溶液c(H+)≥0.1 mol/L | |
| B. | 把该溶液稀释成1 L后,pH≥2 | |
| C. | 把该溶液稀释成1 L后,pH≤2 | |
| D. | 中和此溶液需0.1mol/L的NaOH体积≥100mL |