题目内容
11.室温下,某一元碱A与0.01mol/L某一元强酸等体积混合后所得溶液的pH为7.下列说法中正确的是( )①若A为强碱,其溶液的物质的量浓度等于0.01mol/L
②若A为弱碱,其溶液的物质的量浓度大于0.01mol/L
③反应前,A溶液中c(OH-)一定是0.01mol/L
④反应后,混合溶液中阴离子的总浓度大于阳离子的总浓度.
| A. | ①② | B. | ③④ | C. | ①②③ | D. | ①②③④ |
分析 室温下,某一元碱A与0.01mol/L某一元强酸等体积混合后所得溶液的pH为7,溶液呈中性;
①若A为强碱,生成的盐是强酸强碱盐,混合溶液呈中性,则酸碱物质的量相等,根据二者体积确定浓度浓度关系;
②若A为弱碱,生成的盐是强酸弱碱盐,盐溶液呈酸性,要使混合溶液呈中性,则碱应该稍微过量;
③混合溶液呈中性,如果碱是强碱,则酸碱浓度相等,如果碱是弱碱,则酸浓度应该稍微小于碱浓度;
④任何电解质溶液中都存在电荷守恒,根据电荷守恒判断.
解答 解:室温下,某一元碱A与0.01mol/L某一元强酸等体积混合后所得溶液的pH为7,溶液呈中性;
①若A为强碱,生成的盐是强酸强碱盐,混合溶液呈中性,则酸碱物质的量相等,酸碱体积相等,则二者浓度相等,所以碱溶液浓度为0.01mol/L,故正确;
②若A为弱碱,生成的盐是强酸弱碱盐,盐溶液呈酸性,要使混合溶液呈中性,则碱应该稍微过量,二者体积相等,则碱浓度应该大于0.01mol/L,故正确;
③混合溶液呈中性,如果碱是强碱,则酸碱浓度相等,如果碱是弱碱,则酸浓度应该稍微小于碱浓度,所以反应前,A溶液中c(OH-)一定等于或小于0.01mol/L,故错误;
④任何电解质溶液中都存在电荷守恒,根据电荷守恒得混合溶液中阴离子的总浓度等于阳离子的总浓度,故错误;
故选A.
点评 本题考查酸碱混合溶液定性判断,为高频考点,根据溶液酸碱性结合碱的强弱判断碱浓度大小,注意:任何电解质溶液中都存在电荷守恒,与溶液浓度、电解质强弱、溶液导电性强弱都无关,题目难度不大.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
2.下列装置或操作能达到实验目的是( )
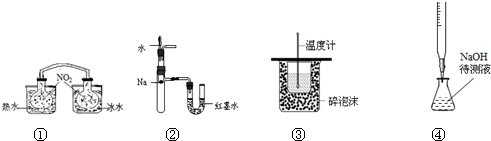

| A. | 装置①依据两容器内气体颜色变化,判断反应2NO2(g)?N2O4(g)平衡移动的方向 | |
| B. | 装置②依据反应后U管两边液面的高低,判断Na和水反应的热效应 | |
| C. | 装置③测定稀强酸与稀强碱反应的中和热 | |
| D. | 装置④用标准的盐酸溶液滴定待测的氢氧化钠溶液(部分加持仪器略去) |
19.对于淀粉和纤维素的叙述,正确的是( )
| A. | 因为都是多糖,所以都有甜味 | |
| B. | 因为具有相同的分子式(C6H10H5)n,所以互为同分异构体 | |
| C. | 两者都能水解为葡萄糖 | |
| D. | 两者都是人类的营养食物 |
16.下列对摩尔的叙述中不正确的是( )
| A. | 摩尔是一个单位,用于计量物质所含微观粒子的数量 | |
| B. | 摩尔是一个物理量 | |
| C. | 1mol任何气体所含的气体分子数目都相等 | |
| D. | 摩尔既能用来计量纯净物,又能用来计量混合物 |
20.压强变化不会使下列化学反应的平衡发生移动的是( )
| A. | 3 H2(g)+N2(g)?2NH3(g) | B. | H2(g)+I2(g)?2 H I(g) | C. | 2SO2(g)+O2(g)?2SO3(g) | D. | C(s)+CO2(g)?2CO(g) |
1.向Fe(OH)3胶体中逐滴加入一种液体,首先发生凝聚而沉淀,然后继续加入时沉淀又消失.这种加入的液体可能是下列物质中的( )
| A. | 0.05mol•L-1的H2SO4溶液 | B. | 0.05mol•L-1的MgSO4溶液 | ||
| C. | 0.05mol•L-1的KCl溶液 | D. | 蒸馏水 |
 如图所示,将锌、铜通过导线相连,置于稀硫酸中.
如图所示,将锌、铜通过导线相连,置于稀硫酸中.