题目内容
15.氮化钠(Na3N)是科学家制备的一种重要化合物,它与水作用可产生NH3,请回答:(1)Na3N的电子式
 ,该化合物是由离子键形成.
,该化合物是由离子键形成.(2)Na3N与水反应方程式为Na3N+3H2O=3NaOH+NH3↑.
(3)Na3N放入足量盐酸中生成2种盐,其化学式为NaCl、NH4Cl.
(4)比较Na3N中两种粒子的半径:r(Na+)<r(N3-)(填“>”“=”或“<”)
分析 (1)氮化钠为离子化合物,根据离子化合物的电子式书写方法写出其电子式;
(2)根据原子守恒,判断出氮化钠与与水反应产物,写出反应的化学方程式;
(3)根据氮化钠与水的反应,判断氮化钠与盐酸反应产物,写出生成产物的电子式;
(4)具有相同电子层结构的离子,核电荷数与离子半径成反比.
解答 解:(1)钠元素和氮元素分别是活泼的金属和活泼的非金属,所以二者形成的化学键是离子键,Na3N的电子式为: ,
,
故答案为: ;离子;
;离子;
(2)Na3N电离出Na+、N3-,H2O电离出H+、OH-,N3-和H+结合成为NH3,Na+与OH-结合成为NaOH,氮化钠和水发生了复分解反应,反应的方程式是:Na3N+3H2O=3NaOH+NH3↑,
故答案为:Na3N+3H2O=3NaOH+NH3↑;
(3)氮化钠和水反应生成氨气,则根据原子守恒可判断,另外一种生成物应该是氢氧化钠,所以氮化钠和盐酸反应的生成物应该是氯化钠和氯化铵,共计是2种盐,氯化钠和氯化铵都是离子化合物,氯化钠的化学式为NaCl,氯化铵的电子式为:NH4Cl,
故答案为:2;NaCl;NH4Cl;
(4)Na+与N3-属电子层结构相同的粒子,核电荷数越大半径越小,故Na+的半径小于N3-半径,r(Na+)<r(N3-),故答案为:<.
点评 本题考查化学键的有关判断、化学方程式的书写,题目难度中等,本题是基础性试题的考查,试题基础性强,注重能力的考查,该题有利于巩固学生对教材基础知识的理解,培养学生的规范答题能力,提高学习效率.

练习册系列答案
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
6.下列离子方程式与所述事实相符且正确的是( )
| A. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| C. | 用Ag作电极电解硝酸银溶液:4Ag++2H2O $\frac{\underline{\;通电\;}}{\;}$ 4Ag+O2↑+4H+ | |
| D. | 向AgCl悬浊液中加入饱和NaI溶液反应的离子方程式:AgCl+I-═AgI+Cl- |
3.四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题.
(1)写出Z在元素周期表中的位置第三周期第ⅣA 族.
(2)X的最高价氧化物的电子式为 ,它对应的水化物与Y的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
,它对应的水化物与Y的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
(3)W的最高价氧化物对应的水化物属于共价化合物,(填“离子”或“共价”),W和Z形成的气态氢化物的稳定性大小关系是:NH3>SiH4.(用化学式表示)
W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似(醋酸为一元弱酸),体积和浓度均相等的HW3与X的最高价氧化物对应的水化物的溶液混合,反应的化学方程式是HN3+NaOH=NaN3+H2O(方程式中各物质用化学式表示)
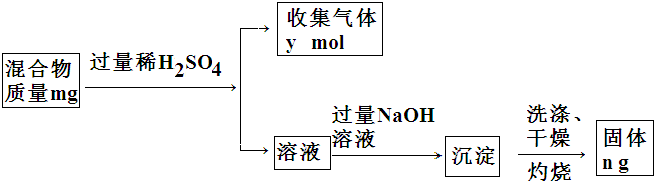
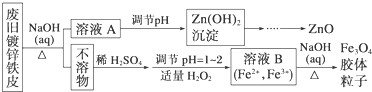
(4)Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数.能确定混合物中Y的质量分数的数据有abc(填序号).
a.m、n b.m、y c.n、y
| W | X | Y | Z | |
| 结构或 性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应 呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小,它的最高价氧化物为两性氧化物 | 最高正价与最低负价之和为零 |
(2)X的最高价氧化物的电子式为
 ,它对应的水化物与Y的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
,它对应的水化物与Y的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.(3)W的最高价氧化物对应的水化物属于共价化合物,(填“离子”或“共价”),W和Z形成的气态氢化物的稳定性大小关系是:NH3>SiH4.(用化学式表示)
W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似(醋酸为一元弱酸),体积和浓度均相等的HW3与X的最高价氧化物对应的水化物的溶液混合,反应的化学方程式是HN3+NaOH=NaN3+H2O(方程式中各物质用化学式表示)
(4)Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数.能确定混合物中Y的质量分数的数据有abc(填序号).
a.m、n b.m、y c.n、y

20.向铜粉和铁粉中加入过量热的浓硝酸,充分反应后,溶液中大量共存的金属阳离子是( )
| A. | Fe2+ | B. | Fe3+ | C. | Fe3+、Cu2+ | D. | Fe2+ Cu2+ |
4.下列各物质中的少量杂质,可用括号内的试剂和方法除去的是( )
| A. | 乙醇中含有水(生石灰,蒸馏) | |
| B. | 甲烷中含有乙烯(溴水,洗气) | |
| C. | 溴苯中溶有溴(苯,分液) | |
| D. | 乙烷中含有乙烯(酸性高锰酸钾溶液,洗气) |
5.将0.1mol N2和0.3mol H2置于密闭容器中发生反应:N2+3H2?2NH3,下列关于该反应的说法中正确的是( )
| A. | 增大压强,反应速率减小 | |
| B. | 最终可生成0.2 mol NH3 | |
| C. | 升髙温度,反应速率增大 | |
| D. | 当V正(N2):V 正(H2)=1:3时,一定达化学平衡状态 |
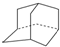 与金刚烷互为同分异构体的是( )
与金刚烷互为同分异构体的是( )